

心脏肥大会导致心室功能障碍和心力衰竭。去泛素化酶通过维持底物蛋白稳定性,在心肌肥厚进程中发挥关键作用。
近日,温州医科大学附属第一医院王毅教授团队在Nature Communications杂志上发表了题为“Cardiomyocyte-derived USP13 protects hearts from hypertrophy via deubiquitinating and stabilizing STAT1 in male mice”的研究文章。该文章揭示了心肌细胞特异性USP13-STAT1轴在心肌肥大中的保护作用,表明针对USP13的心脏特异性基因治疗可能成为心脏肥大治疗的有前景策略。拜谱生物为该研究提供了泛素化修饰组学技术服务。

英文标题:Cardiomyocyte-derived USP13 protects hearts from hypertrophy via deubiquitinating and stabilizing STAT1 in male mice(Nature Communications IF:15.7)
中文标题:心肌细胞来源的USP13通过去泛素化和稳定雄性小鼠的STAT1来保护心脏免受肥大
客户单位:温州医科大学附属第一医院
研究材料:小鼠细胞
拜谱提供技术:泛素化修饰组学
技术路线:
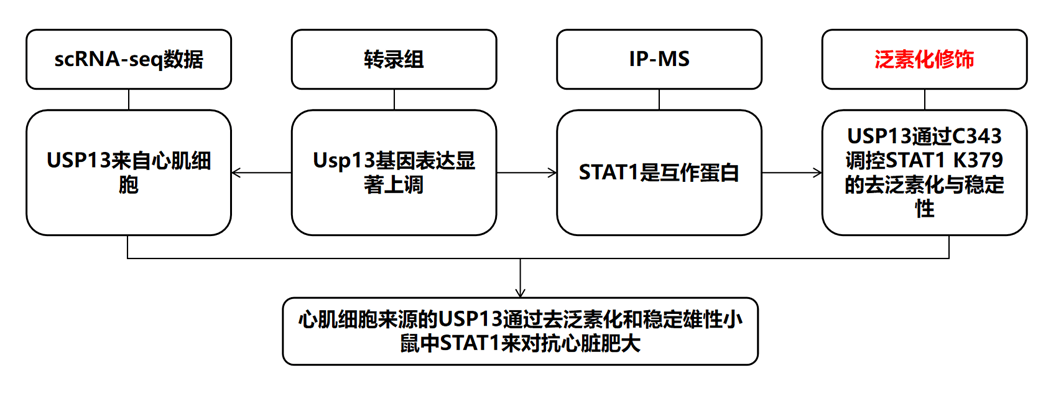
研究结果
1心肌细胞来源的USP13作为心脏肥厚关键因素的鉴定
研究人员在先前发表的转录组数据中发现Usp13基因表达的上调。随后确认了Ang II和TAC诱导的小鼠心脏中Usp13 mRNA水平上调,以及人类肥厚型心肌,相较于正常对照组。最后在单细胞转录组结果中确定心脏中USP13上调的细胞来源是心肌细胞(图1)。
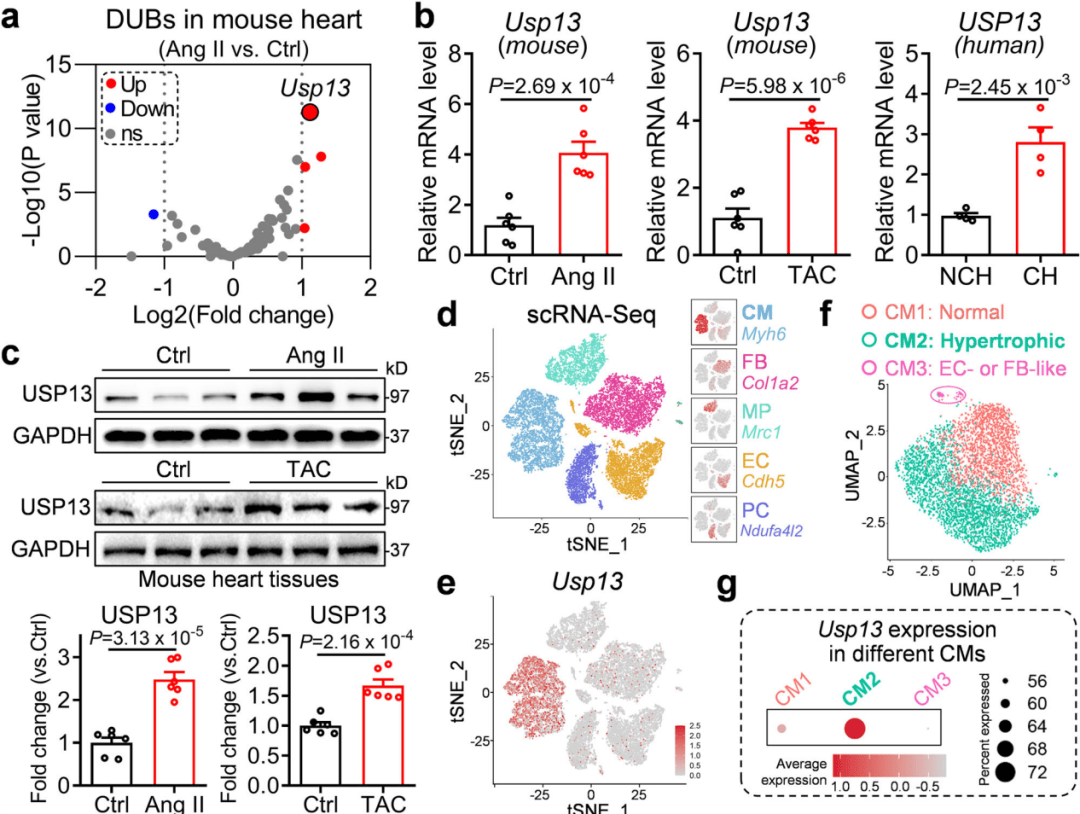
图1 心肌细胞来源USP13作为心脏肥大的重要因素的鉴定
USP13直接结合STAT1,并维持心肌细胞中的STAT1稳定性
研究人员探究USP13对心肌细胞的影响发现USP13敲除加重心脏肥大表现。泛素化通过修饰底物蛋白来实现其特定功能,为了寻找其潜在底物,研究人员用IP-MS分析发现81种在HL-1细胞中与USP13物理相互作用的蛋白质,进一步分析确认USP13在心肌细胞中直接结合STAT1蛋白并且通过防止STAT1降解来提高STAT1水平(图2)。
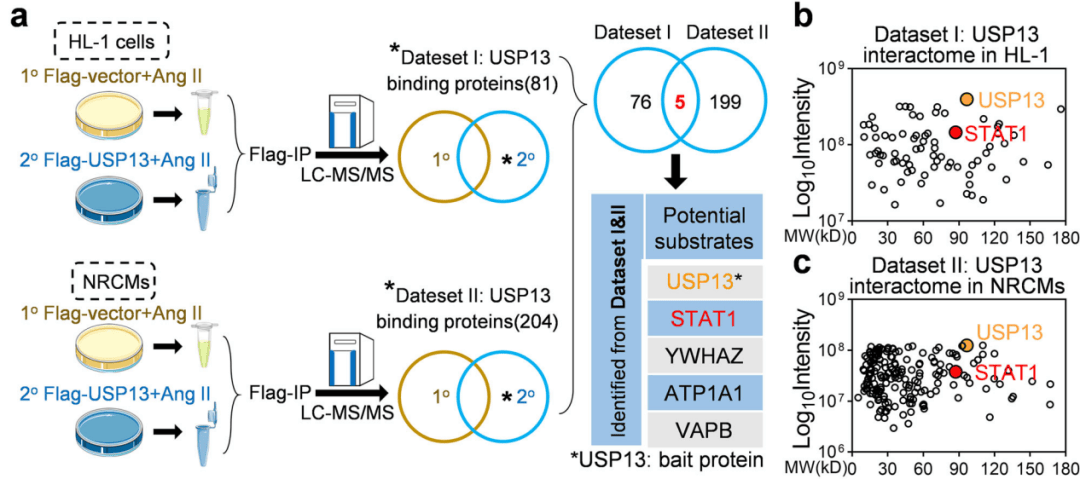 点击添加图片描述(最多60个字)
点击添加图片描述(最多60个字)
图2 USP13直接结合STAT1并保持STAT1的稳定性
3激活的ERK信号介导的EGFR驱动的CD73在肿瘤细胞中的表达
为探究USP13对STAT1泛素化的影响研究人员利用泛素化修饰组学确定USP13介导的STAT1去泛素位点,在STAT1蛋白中鉴定出4个潜在的泛素化赖氨酸残基:K379、K592、K673和K375。进一步研究发现K379参与USP13介导的STAT1脱泛素化,表明USP13通过其活性位点C343,减少STAT1在K379位置的K48关联泛素化(图3)。
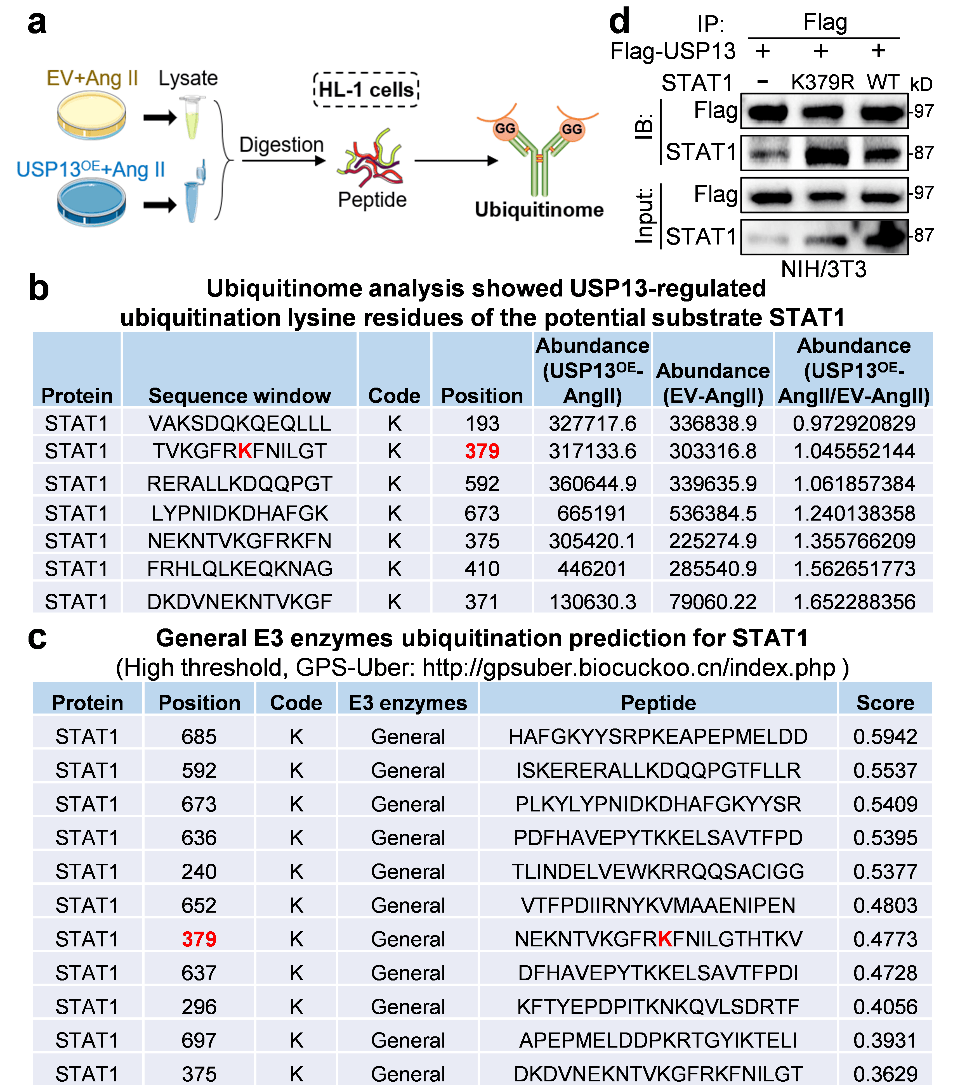
图3 USP13调控STAT1在K379位点的去泛素化
心肌细胞特异性过表达USP13通过调控STAT1改善TAC诱导的既定心功能障碍
最后研究人员探究USP13或STAT1过表达对已形成心肌肥厚的治疗作用,发现USP13对线粒体功能的改善主要是通过STAT1介导,心肌细胞特异性过表达USP13调节STAT1,改善TAC诱导的既定心脏功能障碍。
文章小结
这项研究不仅阐明USP13通过去泛素化作用稳定STAT1的分子机制,更首次揭示心肌细胞特异性USP13-STAT1轴在心肌肥厚中的保护作用,表明靶向USP13的心脏特异性基因治疗有望成为心肌肥厚的新型治疗策略。
拜谱小结
该研究确定了一个心肌细胞特异性USP13-STAT1轴在调节心脏肥厚中发挥重要作用,拜谱生物为该研究提供泛素化修饰组学检测分析服务。拜谱生物可提供完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系,整合多组学数据进行深入挖掘分析,全面解析机制机理等,助力高分文章发表,欢迎咨询!
参考文献
Han J, Lin L, Fang Z, et,al. Cardiomyocyte-derived USP13 protects hearts from hypertrophy via deubiquitinating and stabilizing STAT1 in male mice. Nat Commun. 2025 Jul 1;16(1):5927. doi: 10.1038/s41467-025-61028-1