

骨软骨缺损(OCD)涉及软骨和软骨下骨损伤,因成熟软骨缺乏血液供应,其自我修复能力有限。研究表明,组织再生依赖细胞增殖分化及微环境,尤其是巨噬细胞介导的炎症反应。M1型巨噬细胞促炎,M2型抗炎并促进组织修复。炎症反应失衡会阻碍再生,调节局部炎症微环境对组织修复至关重要。
近期,厦门大学附属中山医院王少杰团队在Journal of Controlled Release杂志上发表题为“Extracellular vesicles derived from aspirin-treated macrophages promote osteochondral tissue regeneration”的文章。研究将阿司匹林处理的M1型巨噬细胞来源的细胞外囊泡(A-EVs)加载到温敏水凝胶中,作为缓释系统。A-EVs能促进M1型巨噬细胞向M2型极化和间充质干细胞(MSCs)的软骨生成,显著促进骨软骨再生。拜谱生物为该研究提供Small RNA测序技术服务。

英文标题:Extracellular vesicles derived from aspirin-treated macrophages promote osteochondral tissue regeneration(J Control Release IF:11.5)
中文标题:阿司匹林处理的巨噬细胞来源的细胞外囊泡促进软骨骨组织再生
客户单位:厦门大学附属中山医院
研究材料:巨噬细胞外泌体
拜谱提供技术:Small RNA测序
技术路线:

研究结果
01、阿司匹林通过PPARα/NF-κB通路促进巨噬细胞极化
通过CCK-8实验评估了阿司匹林对巨噬细胞和MSCs的毒性,发现阿司匹林浓度增加会抑制细胞增殖。ELISA结果显示,阿司匹林处理的M1型巨噬细胞分泌更多抗炎细胞因子,而促炎细胞因子水平降低。流式细胞术和免疫荧光实验表明阿司匹林可促使M1型巨噬细胞向M2型极化。转录组测序分析揭示阿司匹林处理的M1型巨噬细胞差异mRNA显著富集到NF-κB信号通路(图1 A-D)。Western blot实验表明阿司匹林抑制NF-κB表达,增加PPARα表达,免疫荧光、qPCR和双荧光素酶报告系统实验也证实了这一点(图1 E-H))。
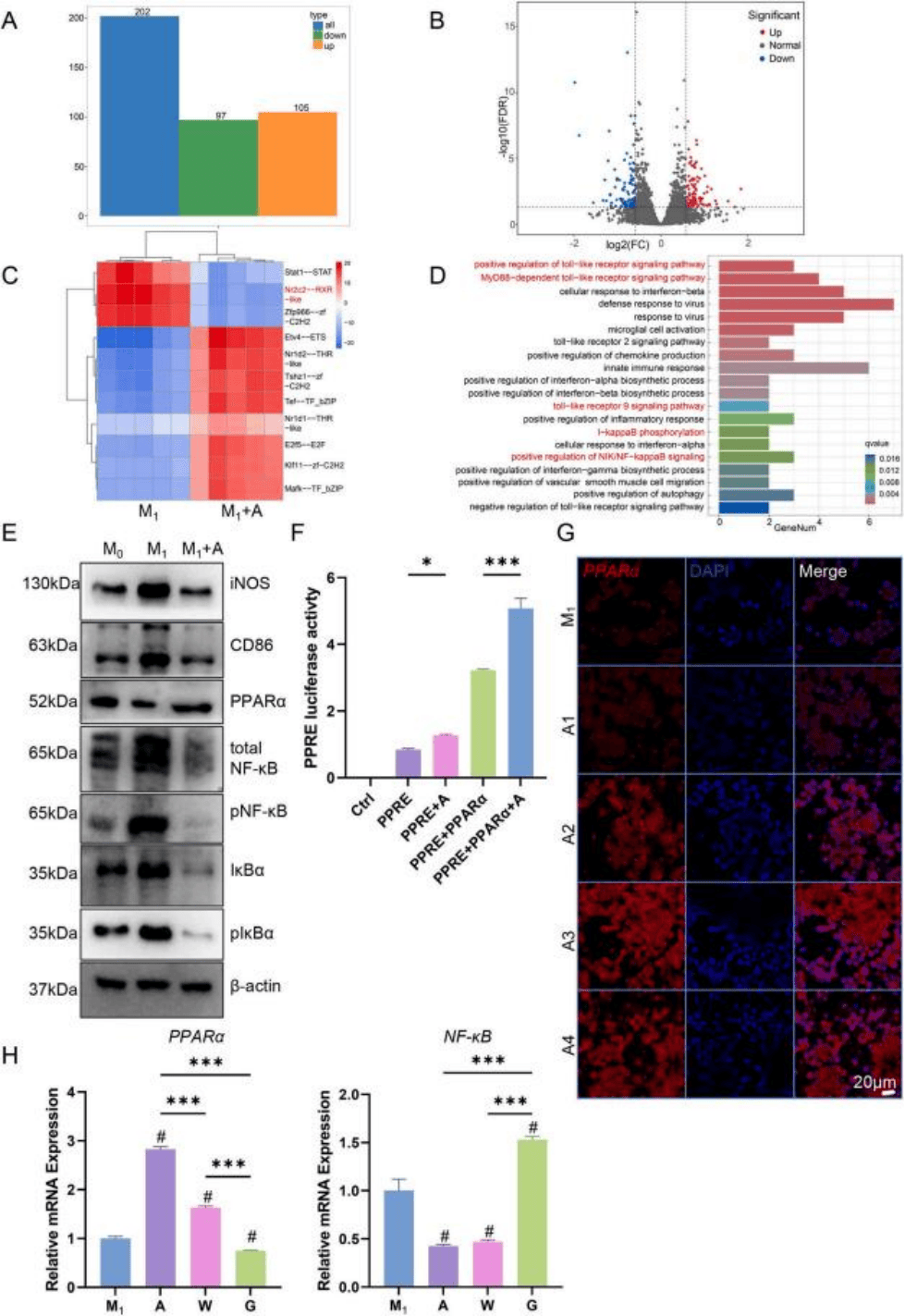 图1 阿司匹林通过激活PPARα调节M1巨噬细胞的表型
图1 阿司匹林通过激活PPARα调节M1巨噬细胞的表型
02、A-EVs体外可促进MSCs的软骨形成,调节巨噬细胞的极化
研究表明,来源于阿司匹林处理巨噬细胞的外泌体(A-EVs)纯度高、粒径约93 nm,能被MSC和巨噬细胞摄取。通过CCK8、qPCR和免疫荧光等体外实验表明,A-EVs促进骨髓间充质干细胞(BMSC)和巨噬细胞增殖,增强M2极化并抑制M1;同时显著提升MSC软骨分化能力,增加Agg、COL2A1、SOX9等表达(图2 C-F)。
为了探究miRNA的作用,后续进行了Small RNA测序,发现A-EVs与1-EVs差异显著,涉及NF-κB、MAPK、TGF-β等通路,其中miR-140-3p被证实为关键分子,介导抗炎和促软骨作用(图2 G-J)。
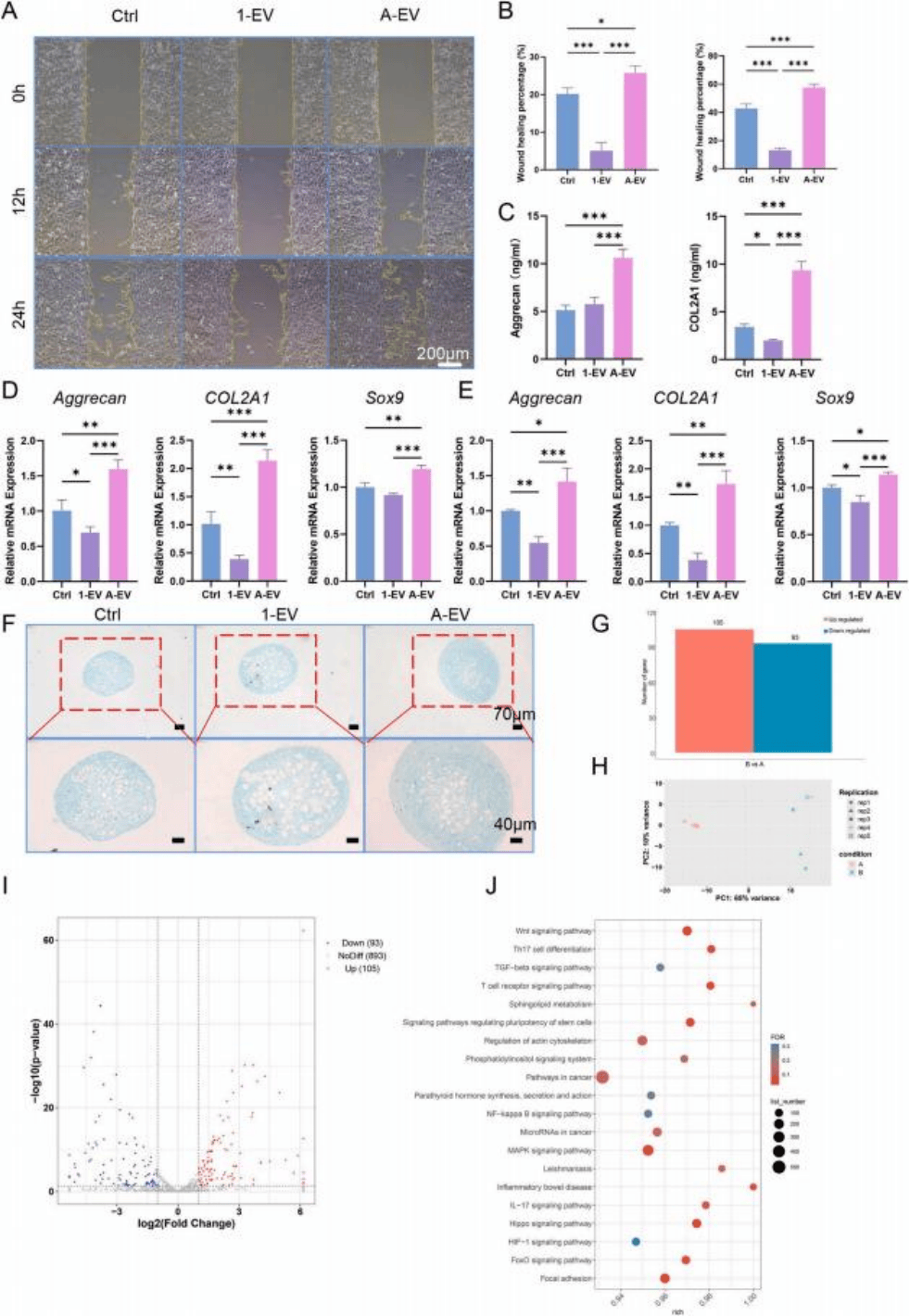 图2 miRNA的测序分析
图2 miRNA的测序分析
03、mPEP水凝胶释放的A-EVs在体内促进骨软骨缺损的再生
mPEP水凝胶可持续释放A-EVs,在大鼠骨软骨缺损模型中显著促进修复。与PBS或1-EVs处理组相比,A-EVs组的缺损区再生组织填充更充分,表现为软骨样结构和整齐的透明软骨层(图3 A-E)。组织学评分和免疫组化结果均表明,mPEP+A-EVs组软骨再生效果最佳。总体表明,A-EVs在体内能有效增强骨软骨缺损修复(图3 F-G)。
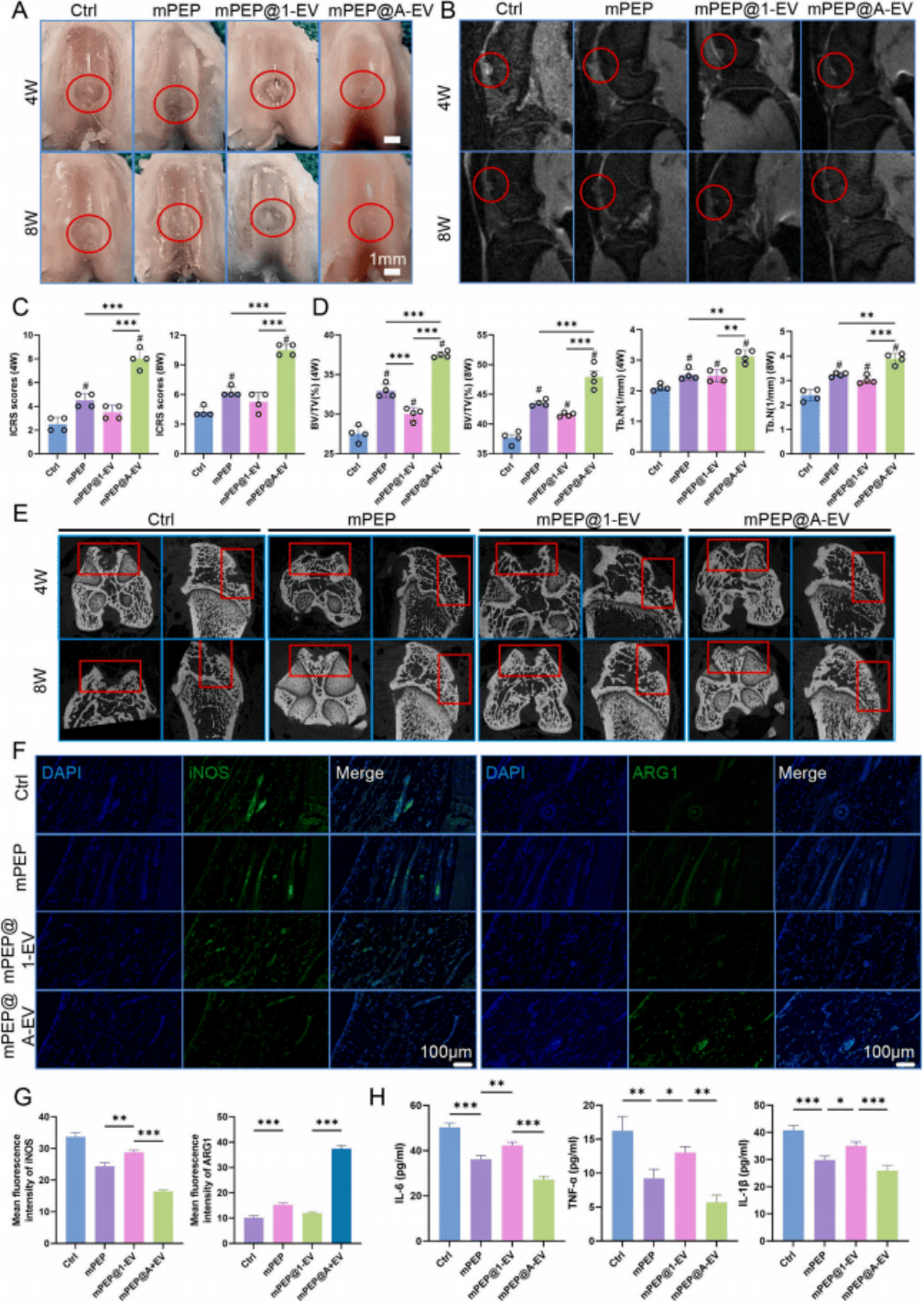 图3 mPEP水凝胶支架用于骨软骨再生的体内评价
图3 mPEP水凝胶支架用于骨软骨再生的体内评价
文章小结
本研究发现阿司匹林可诱导M1巨噬细胞分泌偏向抗炎的细胞因子,A-EVs能促进M1向M2转化及MSC软骨分化,热敏mPEP支架可有效递送A-EVs,实现骨软骨修复(图 4)。该方法为OCD治疗提供新思路,有望降低阿司匹林副作用,具重要临床潜力。
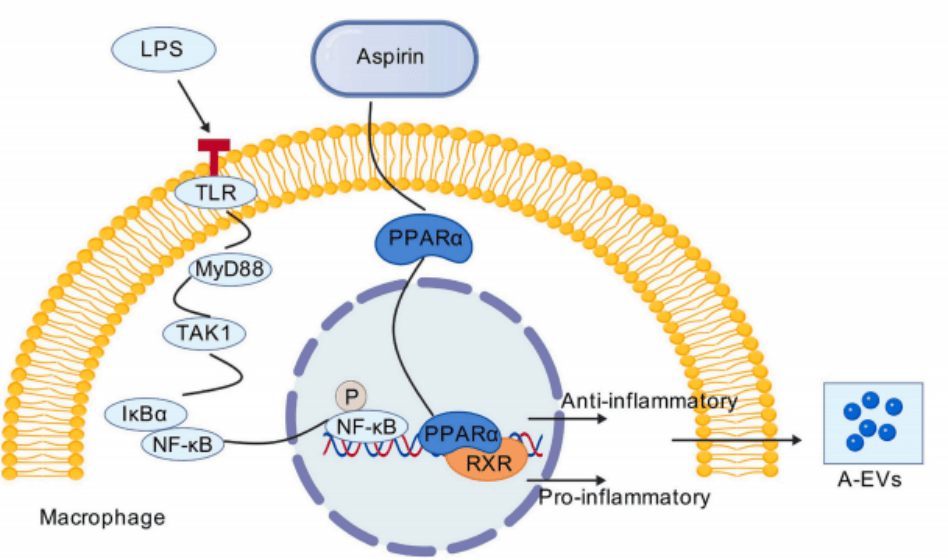 图4 阿司匹林调节巨噬细胞表型的潜在机制
图4 阿司匹林调节巨噬细胞表型的潜在机制
拜谱小结
本研究显著促进了体内软骨骨再生,避免了直接使用阿司匹林导致的愈合延迟问题。拜谱生物为该研究提供了Small RNA测序技术服务。拜谱生物作为一家国内领先的多组学服务公司,可提供完善成熟的蛋白质组学、修饰蛋白质组学、代谢组学、转录组学等多组学产品技术服务体系,整合多组学数据进行深入挖掘分析,全面解析机制机理等,助力高分文章发表。
参考文献:
Peng XZ, Xie CY, Zhuo JJ, et al. Extracellular vesicles derived from aspirin-treated macrophages promote osteochondral tissue regeneration. J Control Release. 2025.