

心血管疾病(CVD)是全球死亡的主要原因,动脉粥样硬化是其主要决定因素。2025年7月16日,西班牙卡洛斯三世国家心血管研究中心(CNIC)David Sancho团队在Nature(48.5)杂志上发表了题为“Imidazole propionate is a driver and therapeutic target in atherosclerosis”的研究文章,揭示了肠道菌群代谢产物丙酸咪唑(ImP)通过激活髓系细胞中的咪唑啉-1受体(I1R)/mTOR通路,驱动动脉粥样硬化发生发展的新机制。

研究结果
01、非靶向代谢组学将ImP与小鼠动脉粥样硬化联系起来
对易患动脉粥样硬化的Apoe−/−小鼠饲喂不同饮食,高胆固醇(HC)饮食诱导动脉粥样硬化,在用补充胆碱(HC/HC)的HC饮食进行抗生素治疗后,动脉粥样硬化得到了部分预防(图1a)。非靶向代谢组学显示不同喂食条件下血浆代谢组的实质性重塑(图1b-c),16SrDNA显示与肠道微生物群组成改变有关(图1d)。非靶代谢组鉴定出了ImP,一种肠道菌群代谢物,与HC喂养时动脉粥样硬化高度相关(图 1f-g)。血浆ImP浓度也与饮食干预后肠道微生物生态学的变化有关(图1h)。
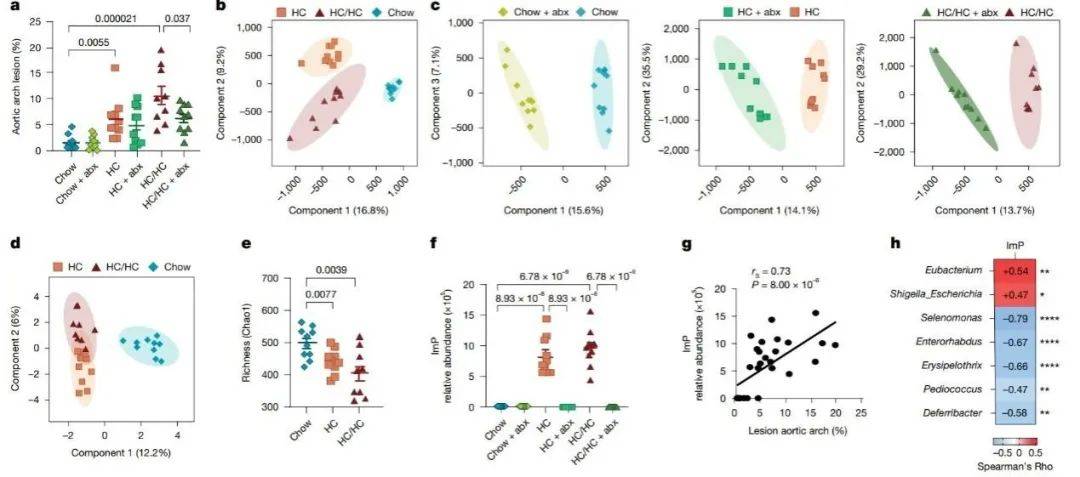 图1 非靶向代谢组学揭示了 ImP 是一种与动脉粥样硬化相关的微生物群依赖性代谢物
图1 非靶向代谢组学揭示了 ImP 是一种与动脉粥样硬化相关的微生物群依赖性代谢物
(图源:Mastrangelo, et al., Nature 2025)
02、ImP与人类亚临床动脉粥样硬化有关
招募295名患有亚临床动脉粥样硬化的受试者和105名没有动脉粥样硬化的对照者,靶向代谢组学定量ImP及其相关代谢物(组氨酸和尿酸)在血浆样品中的含量。与对照组相比,亚临床动脉粥样硬化个体的血浆ImP浓度选择性增加(图2a)。在不同队列中,ImP浓度与动脉粥样硬化和动脉粥样硬化程度之间呈现线性或非线性关联(图2b-d),证实ImP与早期动脉粥样硬化之间的关联。
接下来研究了ImP与已确定的心血管危险因素之间的关联。在这两个队列中,ImP与空腹血糖和不良心脏代谢特征直接相关,包括高敏C反应蛋白(hs-CRP)增加、体重指数(BMI)、内脏脂肪、血脂异常、高血压以及高密度脂蛋白(HDL)-胆固醇降低(图2e-f)。在调整了两个队列中的传统危险因素后,较高的ImP水平与主要动脉粥样硬化结局独立相关(图2g),表明高ImP水平是动脉粥样硬化风险增加的指标。
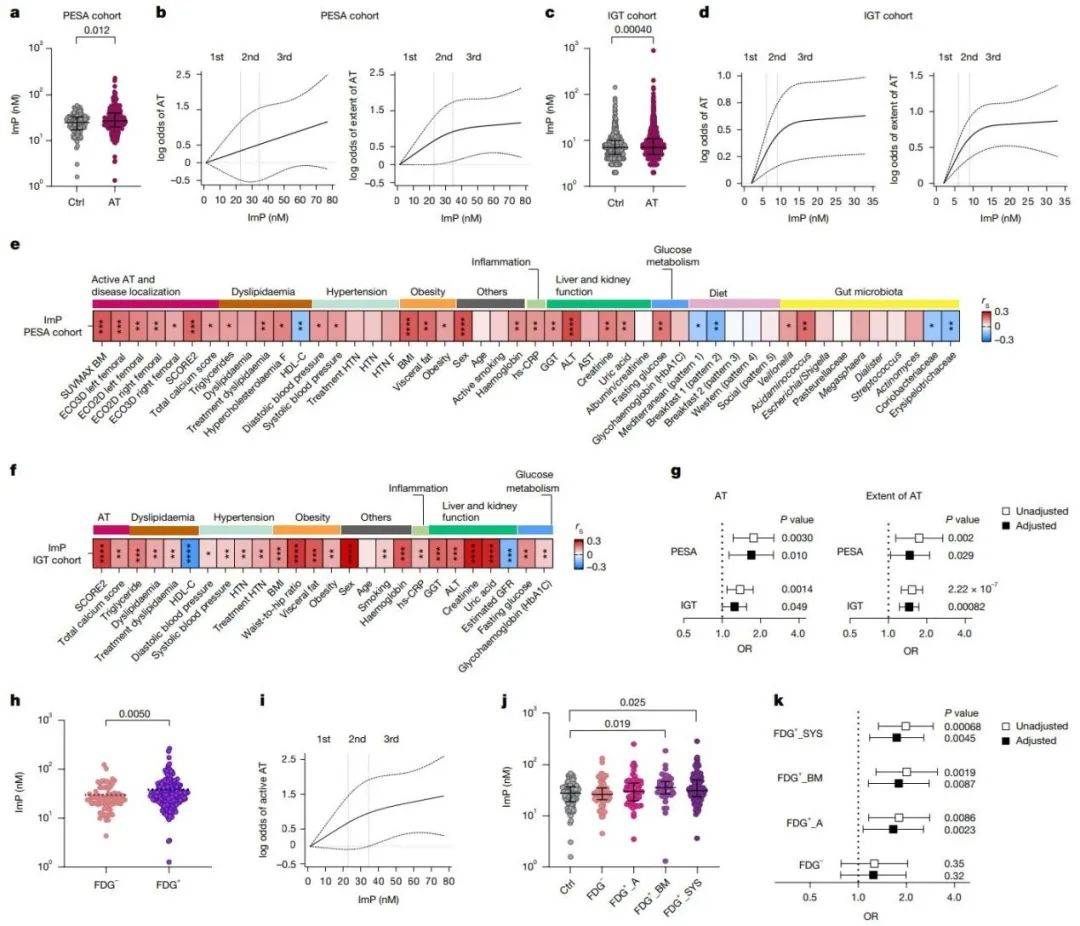 图2 .ImP与人类亚临床动脉粥样硬化相关
图2 .ImP与人类亚临床动脉粥样硬化相关
(图源:Mastrangelo, et al., Nature 2025)
03、ImP导致动脉粥样硬化,但胆固醇没有变化
为了进一步探索ImP对动脉粥样硬化的影响以及因果关系,在动脉粥样硬化易感小鼠的饮用水中施用ImP后发现,ImP补充剂增加了主动脉及根部的动脉粥样硬化发展,而不会影响循环胆固醇或葡萄糖浓度(图3a-b)。值得注意的是,ImP处理的8周Apoe−/−小鼠血液显示促炎性Ly6Chi 单核细胞、T辅助性1(TH1)和T辅助17(TH17)细胞(图3c-d)增加,这与促动脉粥样硬化环境有关。
用ImP处理8周的小鼠主动脉的scRNA-seq显示成纤维细胞、内皮细胞和免疫细胞的相对数量增加(图3e),且富集较多炎症相关通路(图3g)。在缺乏T细胞和B细胞骨髓的小鼠中,ImP诱导动脉粥样硬化的能力显著降低(图3f),确定ImP的致病因素与免疫反应的激活有关。磷酸化修饰组学进一步分析mTOR是ImP的主要靶点(图3h)。
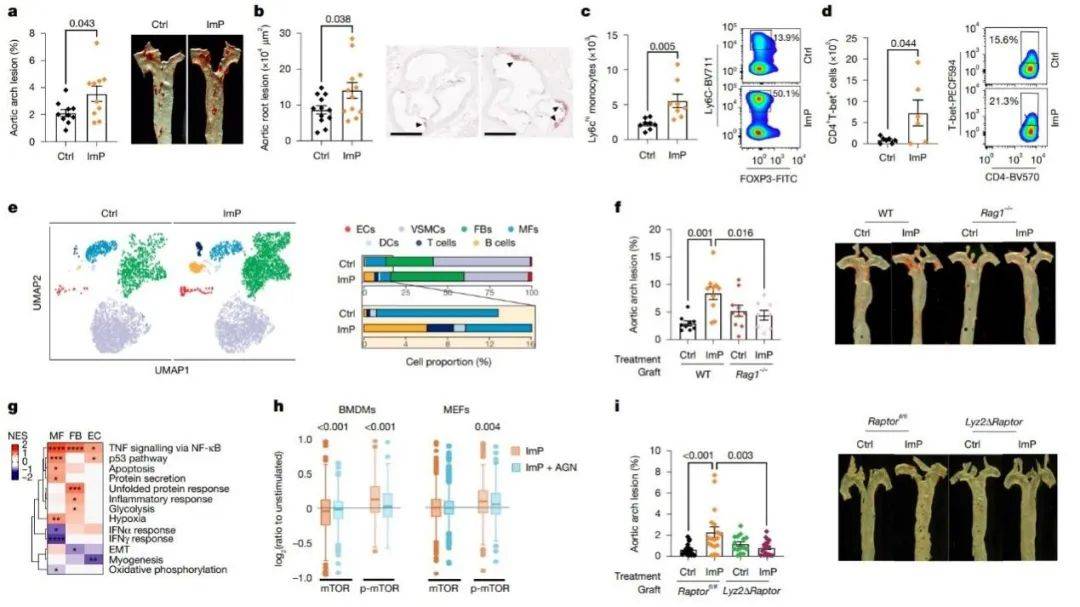 图3. 循环ImP增加动脉粥样硬化易感小鼠的动脉粥样硬化和全身炎症
图3. 循环ImP增加动脉粥样硬化易感小鼠的动脉粥样硬化和全身炎症
(图源:Mastrangelo, et al., Nature 2025)
小结
本研究采用非靶向代谢组学证明ImP与小鼠的动脉粥样硬化进展有关,并且在亚临床队列中验证其与活动性动脉粥样硬化有关,此外,通过单细胞转录组测序,确定ImP主要影响血液中成纤维细胞、内皮细胞和免疫细胞等。磷酸化修饰组学进一步锁定mTOR信号通路是ImP诱发动脉粥样硬化的主要机制。ImP-I1R轴可作为动脉粥样硬化治疗的独立靶点,与当前的治疗协同作用。
拜谱小结
本研究利用代谢组、单细胞转录组、蛋白组及磷酸化修饰组等多组学技术揭示了ImP通过激活髓系细胞中的咪唑啉-1受体(I1R)/mTOR通路,驱动动脉粥样硬化发生发展的新机制,为改善动脉粥样硬化的早期诊断、实现个性化治疗开辟了新的途径。拜谱生物作为一家国内领先的多组学服务公司,可提供完善成熟的蛋白质组学、修饰组学、代谢组学、转录组学等多组学产品技术服务体系,整合多组学数据进行深入挖掘分析,全面解析机制机理等,助力高分文章发表。欢迎咨询
参考文献:
Mastrangelo A, Robles-Vera I, Mañanes D, et al. Imidazole propionate is a driver and therapeutic target in atherosclerosis. Nature. Published online July 16, 2025. doi:10.1038/s41586-025-09263-w