

肺癌是全球最常见的恶性肿瘤,在癌症中死亡率最高。放疗是治疗无法手术的早期或局部晚期肺癌患者的首选选择,而疗效有限和药物在肿瘤内蓄积不良仍然是肺癌放疗面临的关键挑战。
近期,复旦大学沙先谊教授团队在Journal of Nanobiotechnology期刊发表题为“Inhalable biomimetic polyunsaturated fatty acid-based nanoreactors for peroxynitrite-augmented ferroptosis potentiate radiotherapy in lung cancer”的研究文章。该研究开发了一种基于多不饱和脂肪酸(PUFA)的纳米反应器(DHA-N@M),通过靶向富集于肺癌组织,在放疗辅助下诱导铁死亡,增强联合治疗抗癌效果。拜谱生物为该研究提供靶向脂质组学检测分析服务。

英文标题:Inhalable biomimetic polyunsaturated fatty acid-based nanoreactors for peroxynitrite-augmented ferroptosis potentiate radiotherapy in lung cancer(Journal of Nanobiotechnology IF:12.6)
中文标题:可吸入仿生多不饱和脂肪酸纳米反应器通过过氧亚硝酸盐增强铁死亡,增强肺癌放疗效果
客户单位:复旦大学
研究材料:细胞
拜谱提供技术:靶向脂质组学
技术路线:
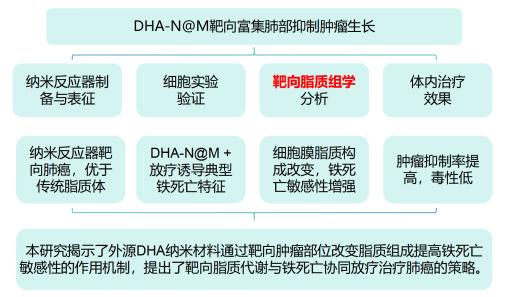
研究结果
1、DHA-N@M的制备与表征
DHA-N@M的制备:合成DHA-SNO、分离巨噬细胞系(RAW 264.7)的细胞膜以制备RCM、将DHA-SNO与RCM孵育30分钟(图1)。通过形态表征发现DHA-N@M为球形形态,能够在雾化和X射线照射期间实现肿瘤特异性激活,从而最大限度地减少正常组织中的脱靶毒性。
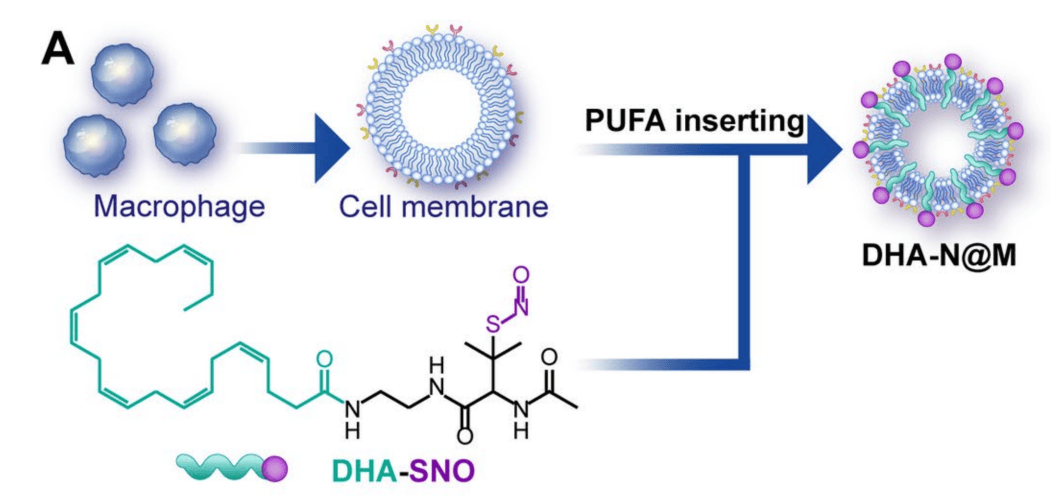 图1 DHA-N@M制备的示意图
图1 DHA-N@M制备的示意图
2、脂质代谢稳态紊乱
研究人员经实验发现DHA-N@M可显著增强放射治疗抗癌效果,进一步探究其对细胞内脂质组成和代谢的影响,使用靶向脂质组学共发现958种脂质,其中398种有显著变化的脂质(图2A-C)。铁死亡是通过使含有PUFA链的磷脂(PL)过氧化来实现的,尤其是磷脂酰乙醇胺(PE)和磷脂酰胆碱(PC),而溶血磷脂(LP)作为氧化PUFA尾部酶促裂解的产物在铁死亡诱导剂处理后增加。多数PUFA、PE-PUFA、PC-PUFA 和LP在DHA-N@M+X射线处理后上调(图2D-G)。在显著变化的脂质种类中,含有单不饱和脂肪酸(MUFA)链和饱和脂肪酸(SFA)链的脂质表达呈下调趋势,不饱和度高的脂质呈增加趋势(图2H-J)。综上所述,DHA-N@M+放疗处理提高了PUFA脂质的水平,导致脂质代谢稳态的扰动和铁死亡的增强。
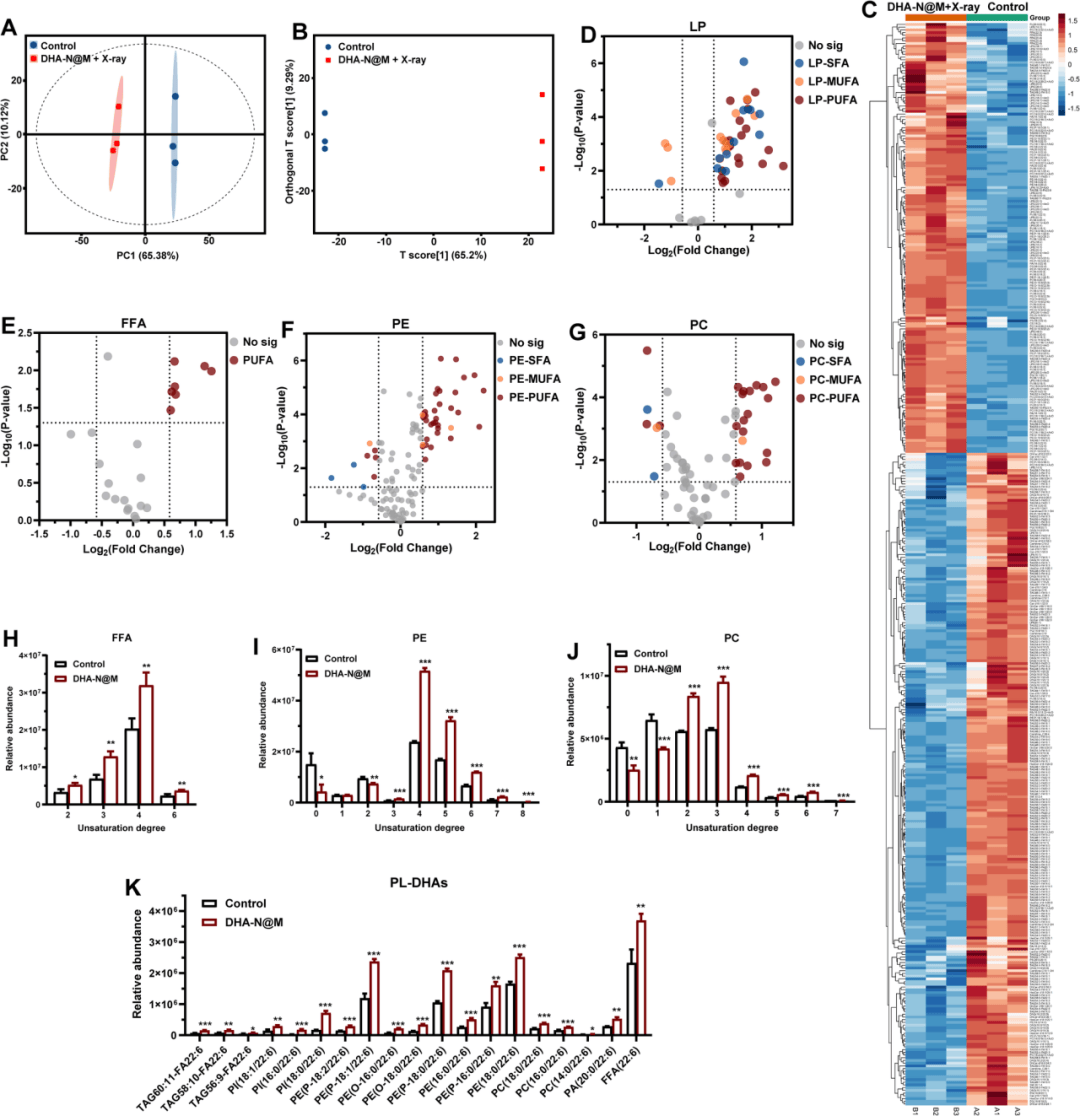 图2 X射线照射下DHA-N@M扰动脂质代谢稳态
图2 X射线照射下DHA-N@M扰动脂质代谢稳态
3、体内抗肿瘤作用
研究人员使用C57BL/6小鼠评估体内抗癌作用(图3A),经过2个周期的吸入放疗后,治疗组均观察到不同程度的肿瘤生长抑制,其中DHA-N@M+X线治疗达到最有效的肿瘤抑制效果(93.91%),生物发光强度最弱(图3B-C)。对照组小鼠解剖的左肺可见明显实体瘤,而DHA-N@M+X线组无明显可见的肺部肿瘤,H&E图像中肿瘤细胞排列松散(图3D-F)。DHA-N@M的优异抗肿瘤作用主要归因于局部吸入递送有助于纳米反应器在肺部积累,以及巨噬细胞膜将纳米反应器引导到肿瘤部位的肿瘤趋向性。同时,在还原TME下,积累在肿瘤部位的DHA-N@M可以分解并释放出NO和DHA,在X射线照射下通过GSH/GPX4耗竭、过氧亚硝基生成、DHA氧化和LPO产生等机制,触发铁死亡效应进而增强治疗效果。
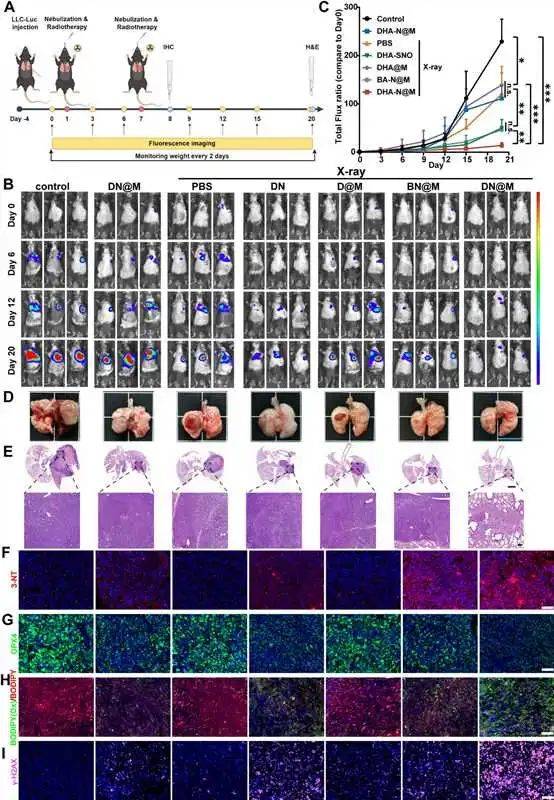 图3 体内治疗效果
图3 体内治疗效果
文章小结
本文中研究人员设计了一种巨噬细胞仿生的DHA-N@M可吸入纳米反应器,通过靶向脂质组学分析揭示了该纳米反应器诱导铁死亡的分子机制。研究证实,该纳米系统能够特异性富集于肺癌组织,通过诱导铁死亡显著增强放疗效果。特别值得注意的是,其创新的吸入给药方式与现有放疗设备具有良好的兼容性,展现出广阔的临床应用前景(图4)。
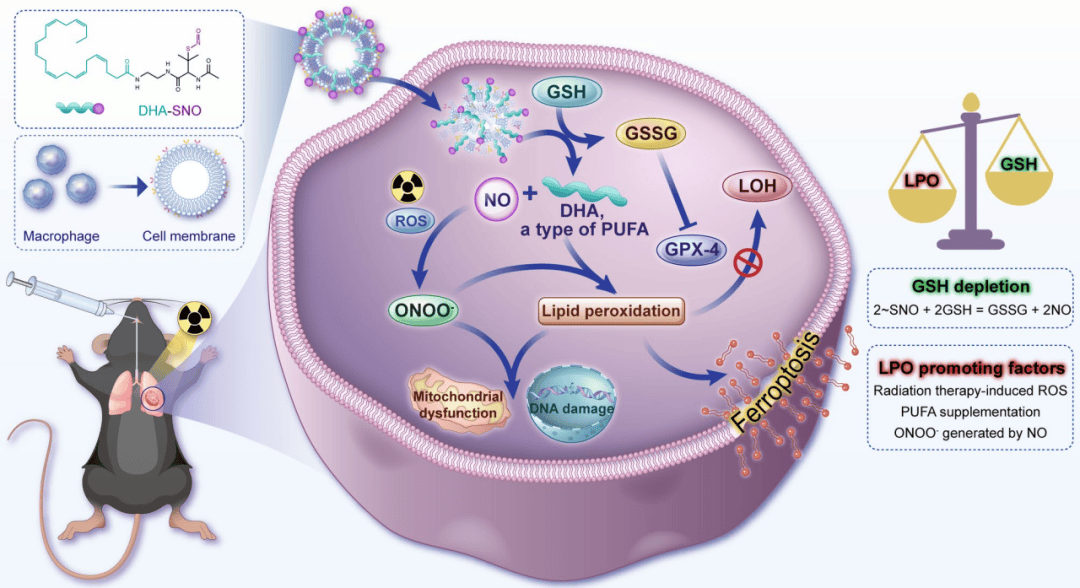 图4 DHA-N@M靶向肺癌组织增强放疗效果作用机制
图4 DHA-N@M靶向肺癌组织增强放疗效果作用机制
拜谱小结
本研究开发了一种纳米反应器(DHA-N@M),能够通过靶向肺癌组织增强铁死亡与放疗的协同效应,为肺癌治疗提供了创新策略。其局部给药方式和肿瘤特异性激活机制也为其他癌症的治疗提供了有价值的借鉴。拜谱生物提供了靶向脂质组学检测分析服务。作为脂质代谢检测领域的深耕者,拜谱生物构建了完善的脂质代谢解决方案,包含:MLT4500医学高通量靶向脂质组、PLT5500植物高通量靶向脂质组、靶向脂质组(2500+)、短链脂肪酸、游离脂肪酸靶向代谢组以及非靶向脂质组,全面赋能脂质代谢研究,欢迎咨询,合作共研!
参考文献:
Chen Y, Huang X, Hu R, et al. Inhalable biomimetic polyunsaturated fatty acid-based nanoreactors for peroxynitrite-augmented ferroptosis potentiate radiotherapy in lung cancer. J Nanobiotechnology. 2025;23(1):338. Published 2025 May 8. doi:10.1186/s12951-025-03409-8