

动脉粥样硬化是心血管、脑血管和周围动脉疾病的核心病理基础,对人体健康构成严重威胁。然而,目前主流治疗方法副作用明显或疗效有限。脉冲电磁场(PEMFs)因其非侵入性和抗炎特性,在动脉粥样硬化治疗中展现出潜力。
近日,四川大学魏全/付琛颖团队在STTT(IF:52.7)上发表题为“Pulsed electromagnetic fields inhibit atherosclerosis by regulating pyroptosis through membrane tension-mediated mechanosensitive channels”的研究论文。研究揭示了脉冲电磁场可通过调节细胞膜张力改善线粒体功能,从而抑制NLRP3炎症小体活化,减少内皮细胞焦亡,最终延缓动脉粥样硬化进展,这一发现为心血管疾病治疗提供了全新思路。拜谱生物为该研究提供了非靶向脂质组学与DIA蛋白组学检测分析服务。

英文标题:Pulsed electromagnetic fields inhibit atherosclerosis by regulating pyroptosis through membrane tension-mediated mechanosensitive channels(Signal Transduction and Targeted Therapy IF:52.7)
中文标题:脉冲电磁场通过膜张力介导的机械敏感通道调控细胞焦亡,从而抑制动脉粥样硬化
客户单位:四川大学
研究材料:血浆,主动脉组织
拜谱提供技术:DIA蛋白组学+非靶向脂质组学
研究路线:
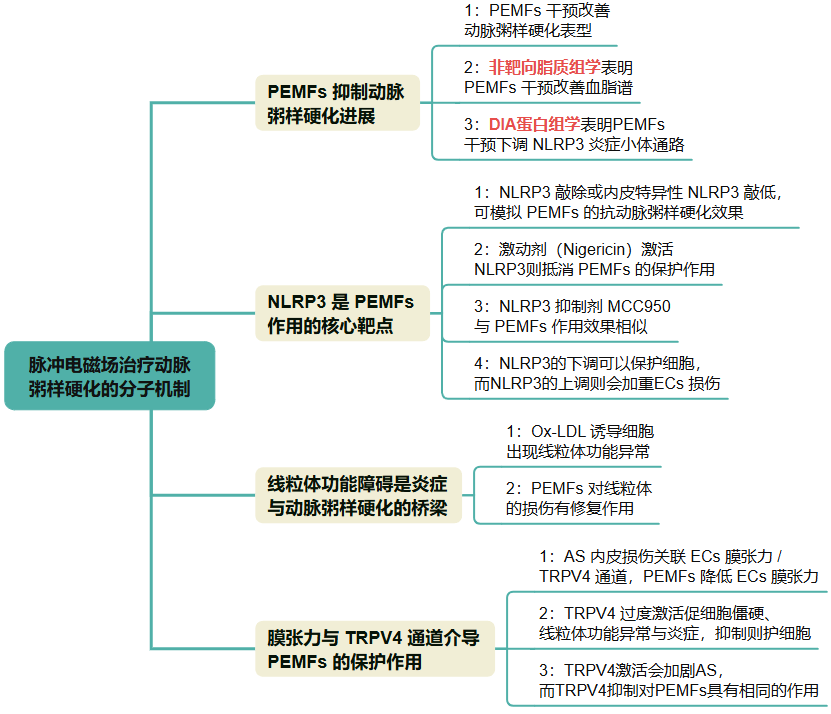
研究结果
01、PEMFs通过抑制焦亡和炎症反应来阻止动脉粥样硬化斑块的形成
PEMFs抑制ApoE-/-小鼠动脉粥样硬化进展:减少病灶负担、降低血管通透性、缩小主动脉弓斑块(图1a-d),与NLRP3炎症小体通路的选择性下调有关(图1e-h),且显著减少小鼠血管内皮细胞(MVEC)焦亡(图1g)。非靶向脂质组学分析结果表明PEMFs主要调节甘油磷脂和胆固醇代谢(图1i-j)。临床层面上,冠心病患者与对照组的DIA蛋白质组学分析显示,冠心病患者NLRP3炎症小体、IL-18受体复合体等通路显著富集,进一步证实ECs是PEMFs靶向NLRP3抗炎的核心细胞介质(图1k-m)。
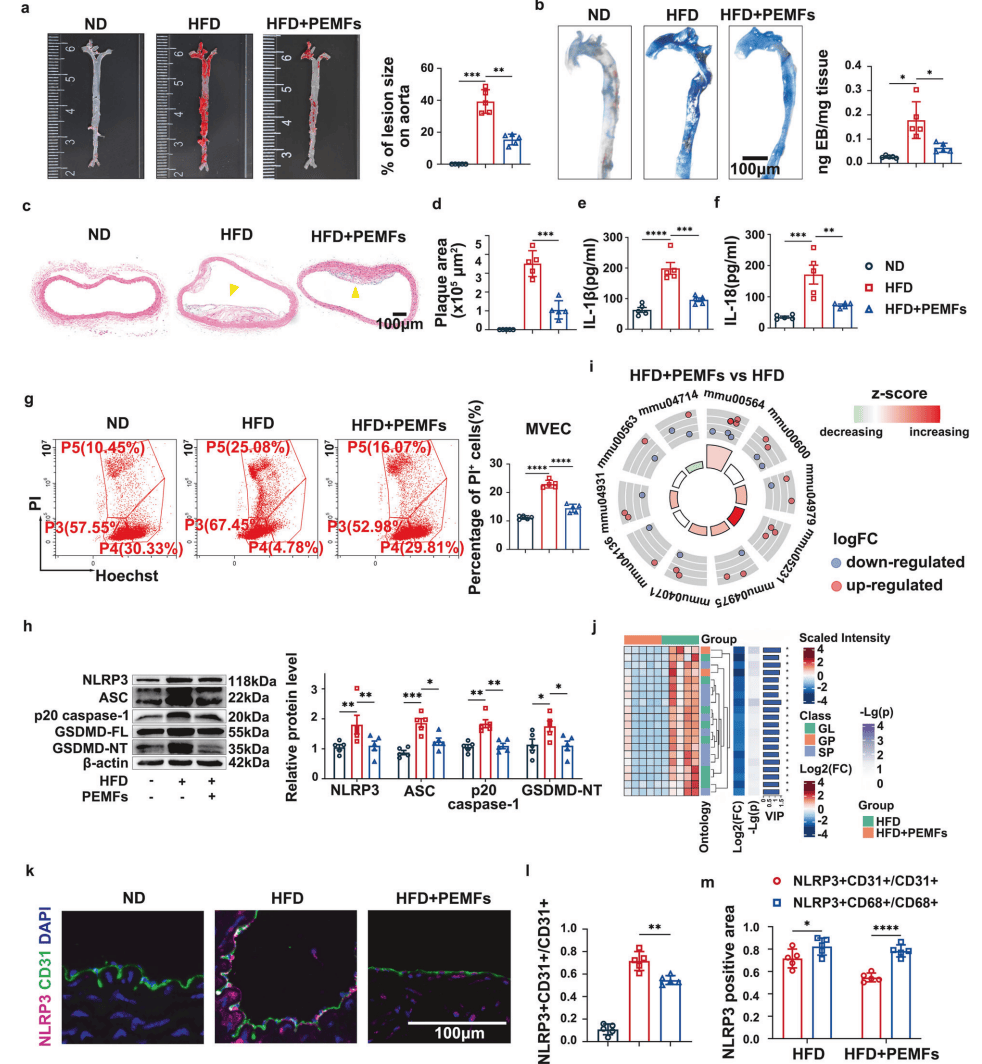 图1:PEMFs抑制动脉粥样硬化斑块的形成
图1:PEMFs抑制动脉粥样硬化斑块的形成
02、NLRP3的双向调控以及NLRP3的内皮特异性
为明确NLRP3在PEMFs抗动脉粥样硬化中的作用,研究采用ApoE-/-NLRP3-/-双敲除(DKO)小鼠,同时在ApoE-/-(AKO)小鼠中用MCC950(抑制剂)、Nigericin(激动剂)调控NLRP3活性。结果证实NLRP3是AS关键驱动因子:Nigericin激活NLRP3会削弱PEMFs保护作用,增加病灶负担、斑块面积及血管通透性(图2a-b),上调NLRP3炎症小体成分与GSDMD-NT表达,促进促炎因子分泌并加重血脂异常(图2c-e);MCC950抑制NLRP3可模拟PEMFs益处。此外,AAV介导的ECs靶向NLRP3敲低进一步明确其内皮特异性作用(图2f-k)。
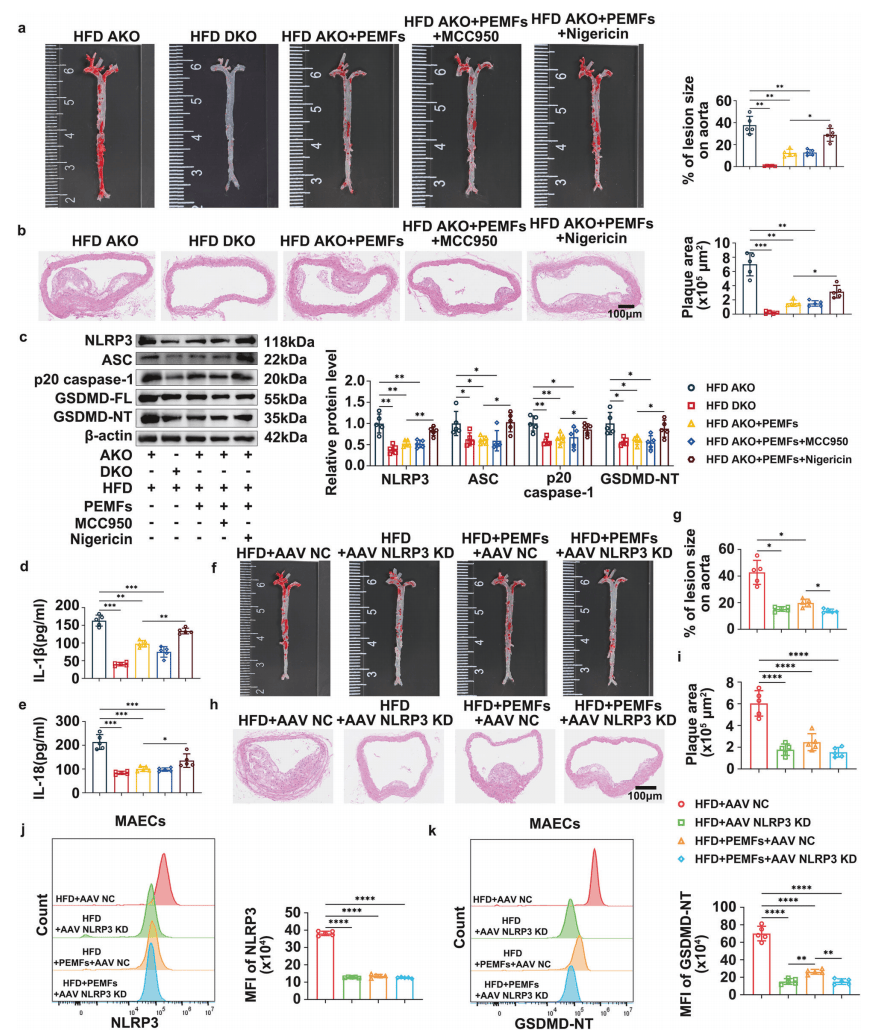 图2:NLRP3的双向调控及内皮特异性
图2:NLRP3的双向调控及内皮特异性
03、线粒体功能障碍是炎症与动脉粥样硬化之间的桥梁
前期研究证实,NLRP3下调可保护细胞,其上调加剧ECs损伤。为明确PEMFs对特定细胞内过程的调控机制,现有研究及人类蛋白质组数据提示:冠心病患者亚细胞水平以线粒体/细胞膜改变为显著特征,且线粒体功能障碍驱动内皮炎症(图3a)。功能检测证实,PEMFs可抑制mPTP开放、恢复线粒体膜电位,改善HUVECs与MVECs线粒体呼吸功能(图3b-m)。
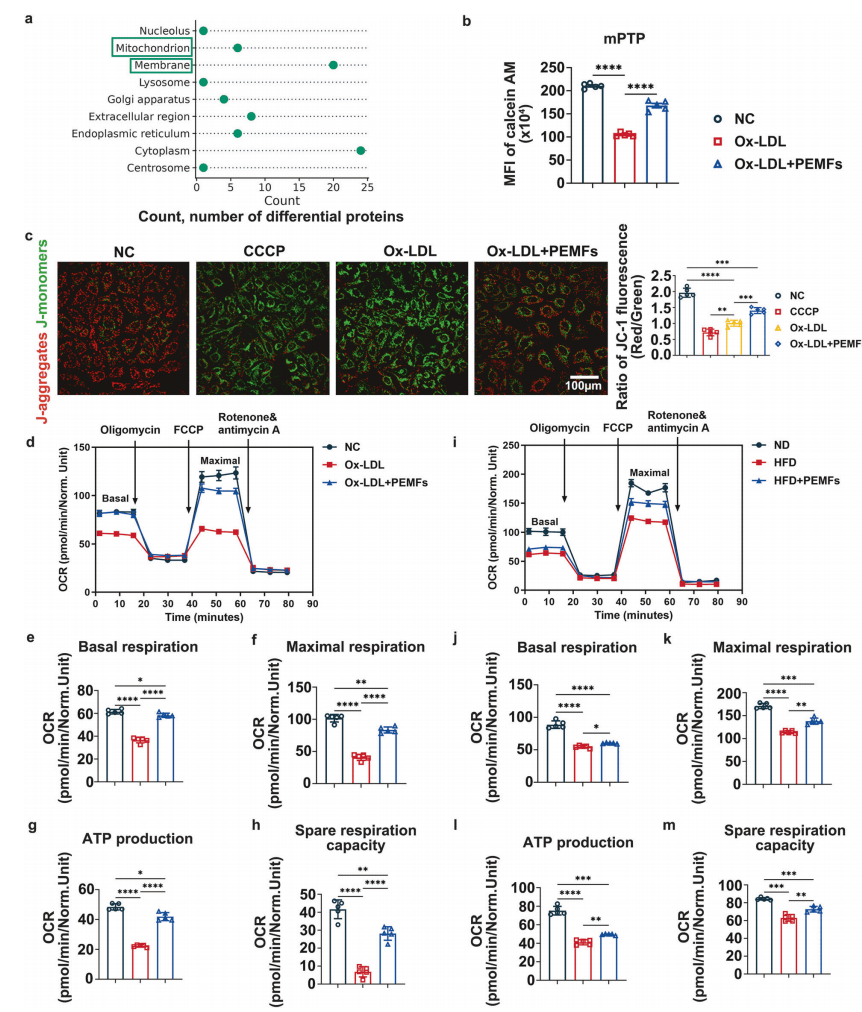 图3:线粒体功能障碍是炎症与动脉粥样硬化之间的桥梁
图3:线粒体功能障碍是炎症与动脉粥样硬化之间的桥梁
04、EC膜张力和TRPV4机械敏感通道参与AS引起的内皮损伤
原子力显微镜(AFM)观察发现:ND组内皮细胞(ECs)形态规则、排列紧凑,HFD组ECs肿胀变形、排列无序、内膜粗糙度及主动脉僵硬度升高,而HFD+PEMFs组细胞形态与排列恢复、僵硬度缓解,PEMF治疗可逆转这些改变(图4a-d)。膜张力探针检测显示,Ox-LDL显著增加了质膜张力,而PEMFs则能减弱该张力(图4e)。膜片钳实验证实,Ox-LDL增强TRPV4通道活性与对激动剂的敏感性,PEMF则抑制该效应(图4f-h),表明TRPV4是介导PEMF保护作用的关键机械传感器。
 图 4.ECs膜张力和TRPV4机械敏感通道参与AS引起的内皮损伤
图 4.ECs膜张力和TRPV4机械敏感通道参与AS引起的内皮损伤
文章小结
本研究使用了ApoE-/-小鼠、ApoE-/-NLRP3-/-敲除小鼠、细胞和血浆样本进行实验,揭示了动脉粥样硬化进展过程中显著的内皮细胞炎症和焦亡。研究发现,PEMFs能够有效抑制NLRP3炎症小体的激活,减少斑块形成,并延缓动脉粥样硬化的进展。蛋白质组分析进一步显示,与炎症和焦亡相关的蛋白表达水平升高,膜蛋白变化尤为显著。机制性研究表明,PEMFs通过调节膜张力和机械性张力介导的TRPV4通道,从而减少焦亡,改善ECs中的线粒体功能障碍(图5)。
 图5
图5
拜谱小结
本研究结合了蛋白组、非靶脂质组学以及多种分子实验揭示脉冲电磁场通过调节膜张力介导的机械敏感通道抑制细胞焦亡,从而抑制动脉粥样硬化的分子机制。拜谱生物为该研究提供了DIA蛋白组学和非靶向脂质组学检测技术。拜谱生物建立了完善成熟的转录组学、蛋白组学、翻译后修饰组学、代谢组学以及多组学联合产品技术服务体系。作为脂质代谢检测领域的深耕者,拜谱生物构建了完善的脂质代谢解决方案,包含:MLT4500医学高通量靶向脂质组、PLT5500植物高通量靶向脂质组、靶向脂质组(2500+)、短链脂肪酸、游离脂肪酸靶向代谢组以及非靶向脂质组, 助力发表高分文献,欢迎致电咨询!
参考文献
Cheng H, Zhang Q, Zhong W, et,al.. Pulsed electromagnetic fields inhibit atherosclerosis by regulating pyroptosis through membrane tension-mediated mechanosensitive channels. Signal Transduction and Targeted Therapy. 2025 Nov 28;10(1):388. doi: 10.1038/s41392-025-02479-2. PMID: 41309549; PMCID: PMC12660931.