

天然B-1a细胞是体内最早”站岗”的免疫卫士,靠终身自我更新维持免疫平衡。TCF1与 LEF1这对转录因子,过去被视为T细胞“干性开关”,如今被证实同样是B-1a细胞的“生命钥匙"。
2025年8月20日,弗朗西斯·克里克(Francis Crick)研究所成员在nature上发布题为“TCF1 and LEF1 promote B-1a cell homeostasis and regulatory function”的文章,研究揭示了TCF1-LEF1(T细胞因子/淋巴增强因子家族成员)转录轴是维持B-1a细胞稳态与调节功能的核心驱动力,二者既保障B-1a细胞的发育、自我更新和代谢,又通过诱导IL-10和PD-L1表达,赋予其免疫调控能力,这一机制为理解人类B-1样细胞及其在感染与自身免疫疾病中的作用奠定了基础。

研究结果
1、TCF1和LEF1在小鼠和人B-1细胞中的作用
根据细胞表面CD5分子的表达与否,可将B-1细胞分为两个亚群:B-1a细胞表达CD5⁺,具有免疫调节功能,能产生抗炎细胞因子IL-10;B-1b细胞不表达CD5(CD5⁻),缺乏免疫调节功能,但在某些细菌感染中具有记忆功能。研究团队通过单细胞测序和流式细胞术发现,TCF1和LEF1在小鼠B-1细胞中高度表达,TCF1在腹腔B-1a细胞中显著表达,而LEF1在胎儿和骨髓B-1前体细胞中表达最高(图1a-d)。进一步,研究团队在人类胸膜感染患者的胸膜液和血液中发现了一类B-1样细胞群体,这些细胞表达CD43和CD5并共表达TCF1和LEF1(图1e-g)。与小鼠B-1细胞类似,这些人类B-1样细胞也表现出PtC反应性(Phosphatidylcholine,PtC,B-1a细胞的典型配体)(图1h),这表明B-1a细胞作为CD5⁺B细胞亚群,且TCF1和LEF1在B-1a细胞中存在特异性表达。基因敲除实验表明,TCF1与LEF1缺失影响B-1a细胞生成与稳态维持。
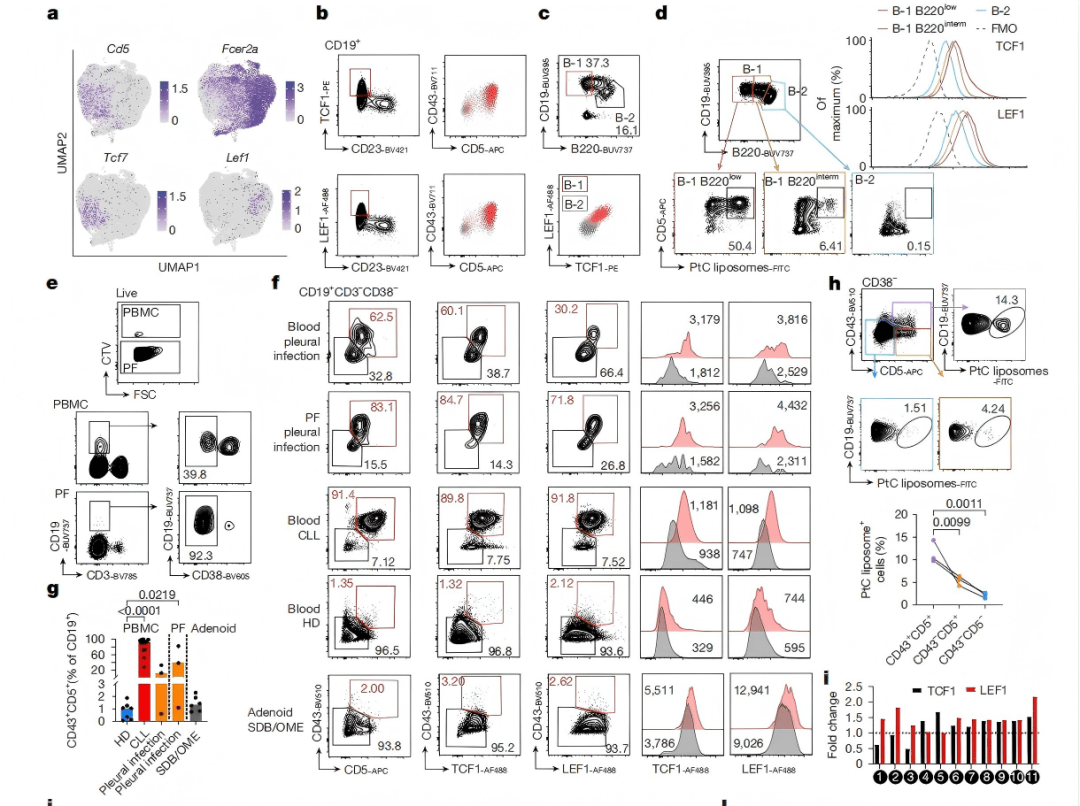 图1 | TCF1和LEF1高表达且TCF1-LEF1缺失小鼠的B-1a细胞减少
图1 | TCF1和LEF1高表达且TCF1-LEF1缺失小鼠的B-1a细胞减少
2 、TCF1-LEF1调控B-1a细胞的自我更新能力
TCF1-LEF1缺失导致B-1a细胞随着发育阶段变化而逐渐减少(图2c)发生发育缺陷,以及自我更新障碍(图2d)。单细胞BCR测序分析显示,TCF1-LEF1缺失小鼠的B-1细胞BCR库多样性降低(图2e-f),PtC结合B细胞数量减少(图2g),表明TCF1和LEF1的表达与结合能力正相关。
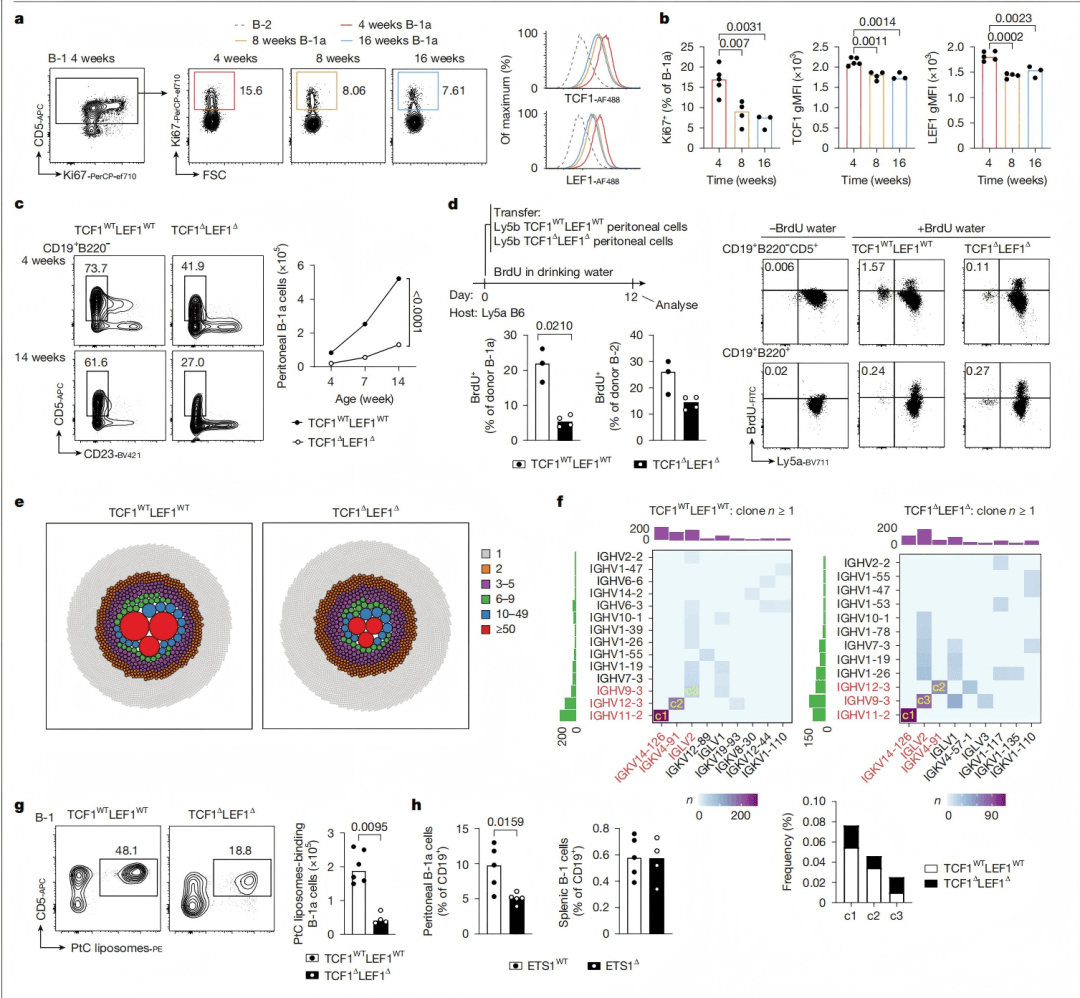 图2 | TCF1和LEF1对B-1a细胞的自我更新所必需
图2 | TCF1和LEF1对B-1a细胞的自我更新所必需
3 、TCF1-LEF1驱动B-1细胞代谢与干细胞样特性
转录组测序分析表明,TCF1-LEF1通过调控MYC依赖的代谢途径为B-1a细胞的自我更新提供能量支持(图3a)。单细胞轨迹分析揭示了B-1细胞发育过程中TCF1和LEF1的动态表达模式(图3c-f)。且TCF1-LEF1促进B-1a细胞产生IL-10,这对于其调节功能至关重要。
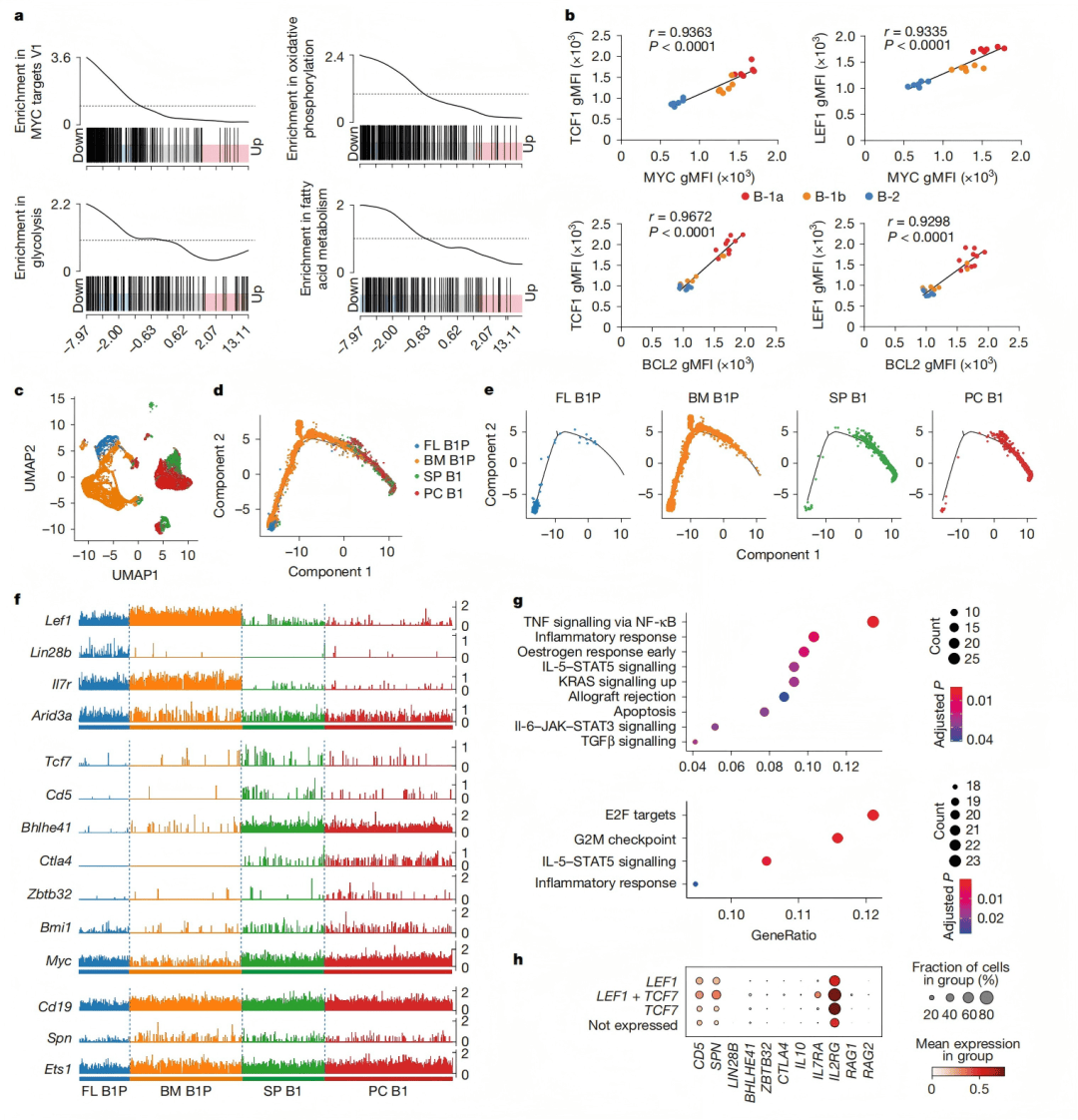 图3 | TCF1-LEF1上调 Ets1和 MYC的靶基因
图3 | TCF1-LEF1上调 Ets1和 MYC的靶基因
4 、TCF1-LEF1促进B-1细胞IL-10产生与免疫调节
在实验性自身免疫性脑脊髓炎(EAE)模型中,TCF1-LEF1缺失B-1细胞无法有效抑制脑部炎症(图4k),证实了这些转录因子对B-1a细胞调节功能的重要性。机制上,TCF1-LEF1通过促进IL-10产生和维持PD-L1表达,限制B-1细胞的过度增殖和耗竭,同时诱导MYC^low干细胞样群体的出现。
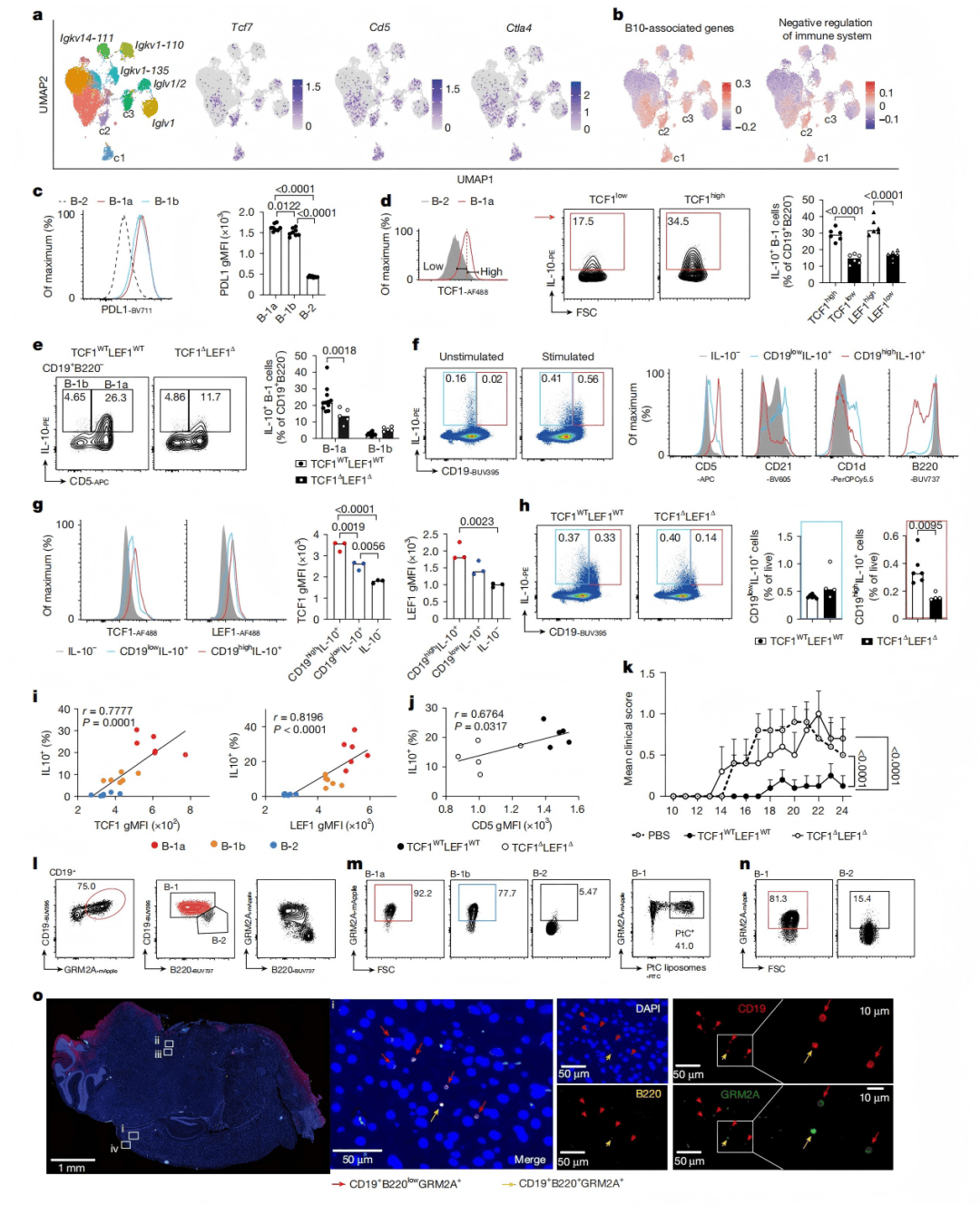 图 4 |TCF1和 LEF1促进 B-1a 细胞产生IL-10并控制中枢神经系统炎症
图 4 |TCF1和 LEF1促进 B-1a 细胞产生IL-10并控制中枢神经系统炎症
5 、TCF1-LEF1调控干细胞样群体、防止耗竭
研究者进一步发现,野生型B-1a细胞在LPS激活后可诱导MYC^low干细胞样群体(图5a-c),进入静息耐久状态以维持功能(图5e-h);而在TCF1-LEF1双缺失细胞中,这一机制消失,导致持续过度增殖、活化标志物无法下调,且PD-L1表达下降(图5k),最终削弱免疫调控作用。
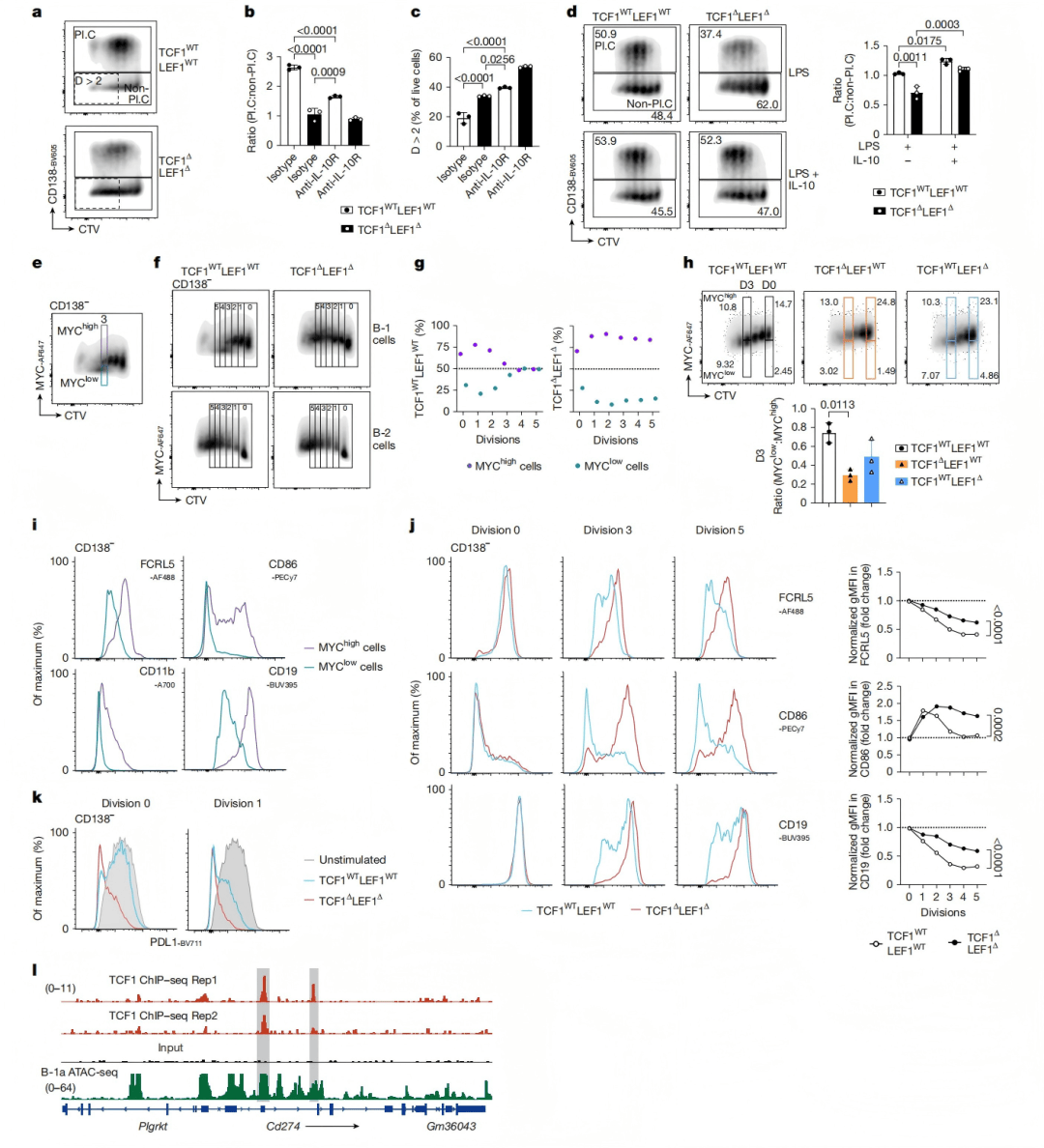 图5|TCF1和LEF1缺失抑制干细胞样B-1细胞的发育并促进细胞耗竭
图5|TCF1和LEF1缺失抑制干细胞样B-1细胞的发育并促进细胞耗竭
6 、人类生物学意义:TCF1-LEF1的免疫调节与生物标志物作用
研究还发现TCF1和LEF1在B-1a细胞中表达模式与人类疾病存在密切关联:胸膜感染患者的胸膜液中,CD43⁺CD5⁺B-1样细胞占比升高, 发生感染应答。且人类CLL细胞(表型为CD43⁺CD5⁺)同样高表达TCF1和LEF1,而LEF1已被证实是CLL的诊断标志物(图6i)。
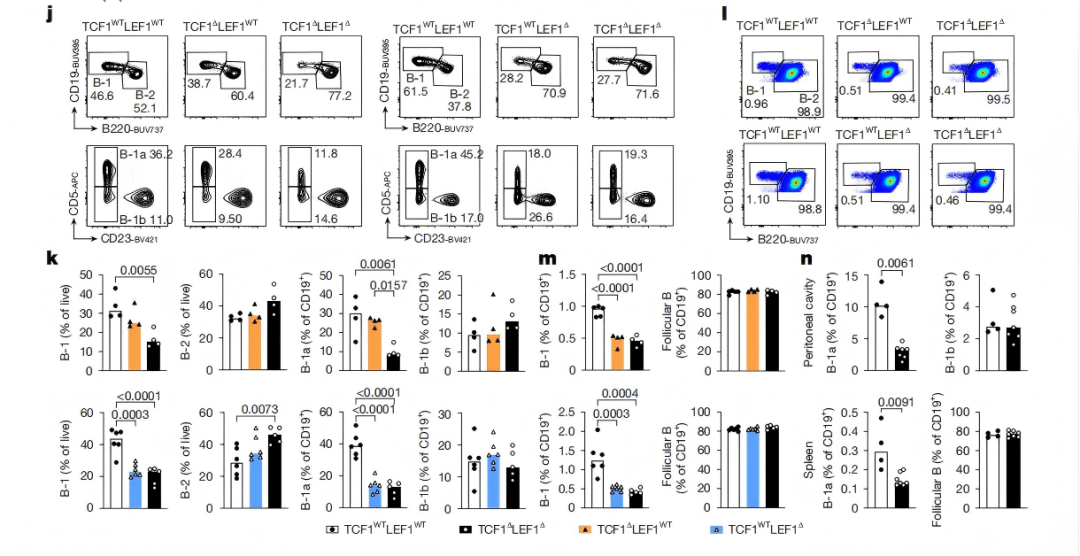 图6|TCF1和LEF1可调控B-1a细胞免疫应答并作为诊断标志物
图6|TCF1和LEF1可调控B-1a细胞免疫应答并作为诊断标志物
文章小结
本研究系统阐明了TCF1和LEF1如何通过调控MYC依赖的代谢途径和IL-10产生来维持B-1a细胞的干性和调节功能。并且研究人员还在人类胸膜感染患者中发现了一类表达CD43、CD5并共表达TCF1和LEF1的B-1样细胞群体,这些发现不仅说明了先天性B细胞生物学意义,也为相关疾病的诊断和治疗提供了理论依据。
拜谱小结
研究团队通过单细胞测序、基因敲除小鼠模型等方法,阐明了TCF1和LEF1通过整合代谢调控、IL-10产生和干细胞样特性来维持B-1a细胞稳态和功能的分子机制,不仅解决了关于人类B-1细胞存在的长期争议,还为炎症性疾病和白血病的治疗提供了新的潜在靶点。发现的B-1样细胞标记物可能成为浆膜感染诊断的新型生物标志物。拜谱生物凭借10x Genomics与墨卓双平台单细胞测序产品布局,以及蛋白组、代谢组、修饰组学、转录组等多组学,实现从医学到农学的多领域应用场景覆盖,为基础科研与临床转化提供更灵活、更全面的单细胞解决方案。欢迎咨询!
参考文献:
Shen, Qian et al. “TCF1 and LEF1 promote B-1a cell homeostasis and regulatory function.” Nature, 10.1038/s41586-025-09421-0. 20 Aug. 2025, doi:10.1038/s41586-025-09421-0