

肝内胆管癌(ICC)是一种高度致死的肝恶性肿瘤,对化疗反应率较差。亮氨酰-tRNA合成酶1(LARS1)在ICC中显著下调,特别是在晚期肿瘤患者中,并且与患者生存率呈正相关。
2025年7月17日,山东大学靳斌团队和李景新团队在Journal of Hepatology期刊上发表题为“Restoration of N-glycosylation via leucine-activated leucyl-tRNA synthetase 1 overcomes chemoresistance in intrahepatic cholangiocarcinoma”的研究文章,采用N-糖基化修饰组、多聚核糖体分析和核糖体-新生链测序(RNC-seq)等方法,揭示了LARS1可选择性下调N-聚糖生物合成酶(ALG3、RFT1和ALG12)的翻译效率,使耐药蛋白ABCC1的N-糖基化受损,从而增强药物外排活性并促进化疗耐药的分子机制。拜谱生物为该研究提供了蛋白质组学和N-糖基化修饰组服务。


英文标题:Restoration of N-glycosylation via leucine-activated leucyl-tRNA synthetase 1 overcomes chemoresistance in intrahepatic cholangiocarcinoma (Journal of Hepatology IF:33)
中文标题:通过亮氨酸激活的亮氨酰-tRNA合成酶1恢复N-糖基化可克服肝内胆管癌的化疗耐药性
客户单位:山东大学齐鲁医院
研究材料:细胞系
拜谱提供技术:蛋白质组学、N-糖基化修饰组
技术路线:
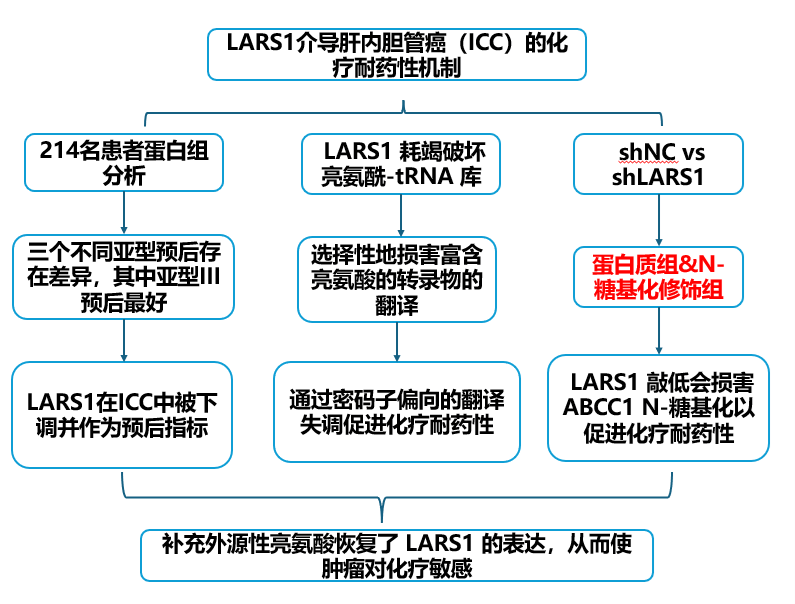
研究结果
LARS1在ICC中被下调并作为预后指标
为了确定ICC的预后生物标志物,对214名患者的蛋白质组学数据进行聚类,将队列分为三种具有不同生存结局的分子亚型:C-I(n=74)、C-II(n=73)和C-III(n=67)(图1A-B)。C-III亚型预后最好,C-II亚型预后最差(图1C)。对亚型富集蛋白的KEGG通路分析显示,C-III组显著富集于翻译相关通路,包括核糖体生物发生和氨酰基-tRNA生物合成,提示翻译活性增强与临床结局改善之间存在联系。
与相邻的肿瘤周围样本相比,LARS1在mRNA和蛋白质水平上显示出明显的肿瘤组织减少(图1F-I)。此外,低LARS1表达与患者生存率降低显著相关。
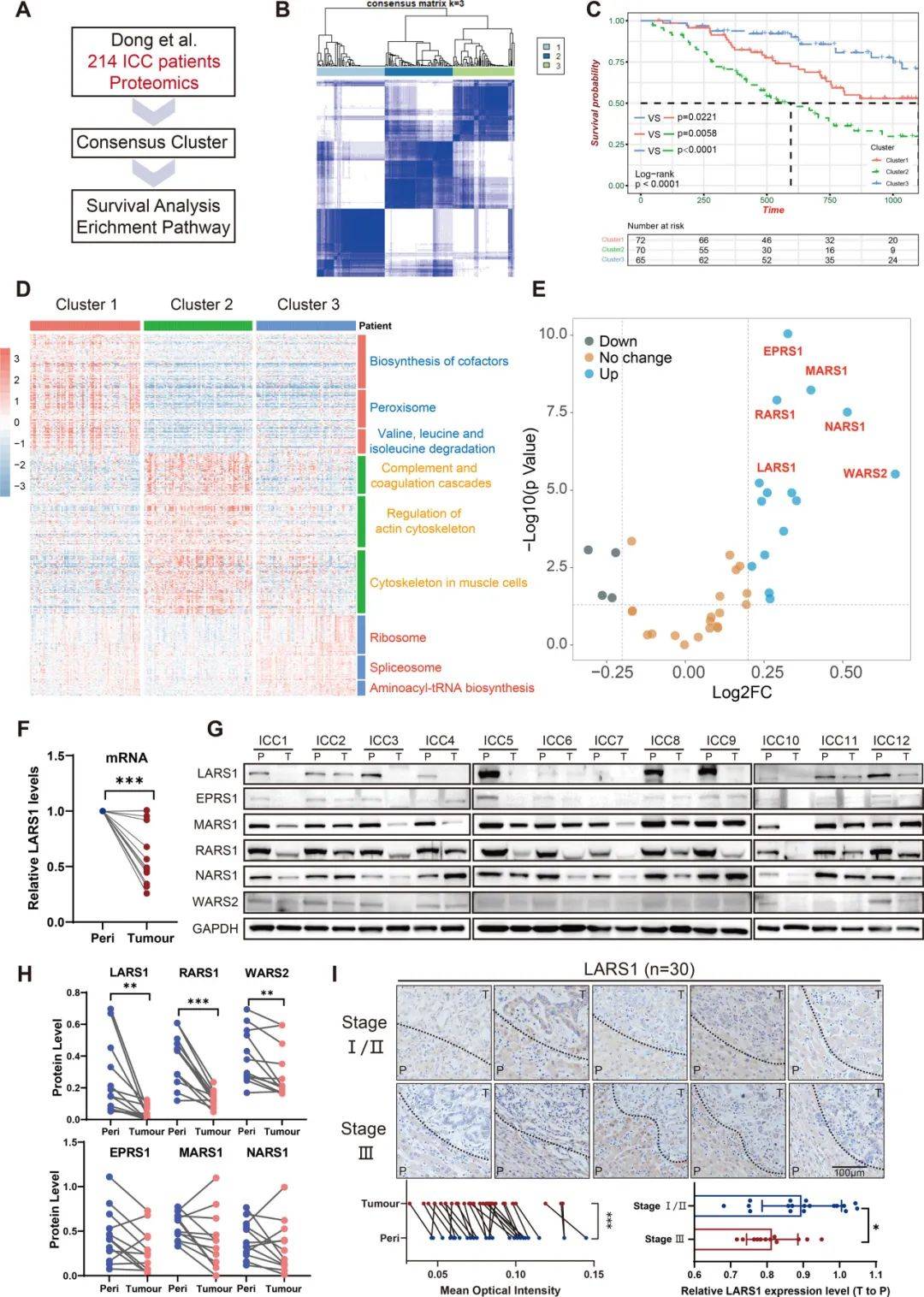 图1 LARS1在ICC中被下调并作为预后指标
图1 LARS1在ICC中被下调并作为预后指标
LARS1酶促5个带电tRNALeu同工受体,LARS1可调控5种亮氨酸相关的tRNA,敲低LARS1通过降低亮氨酰tRNA表达驱动化疗抵抗
LARS1酶促5个带电tRNALeu同工受体,维持有效翻译所需的亮氨酰-tRNA库(图2A)。LARS1敲低细胞中带电的LeuAAG和LeuCAGtRNA减少,过表达LeuCAGtRNA部分恢复了吉西他滨-奥沙利铂的敏感性,并逆转了化疗耐药表型(图2B-D)。接下来在对照细胞和LARS1敲低细胞中进行了RNC-seq,发现914个转录本减少,542个转录本翻译(TR)增加(图2G-H),LARS1耗竭会破坏亮酰-tRNA库,选择性地损害富含亮氨酸的转录物的翻译,并通过密码子偏向的翻译失调促进化疗耐药性(图2G-L)。
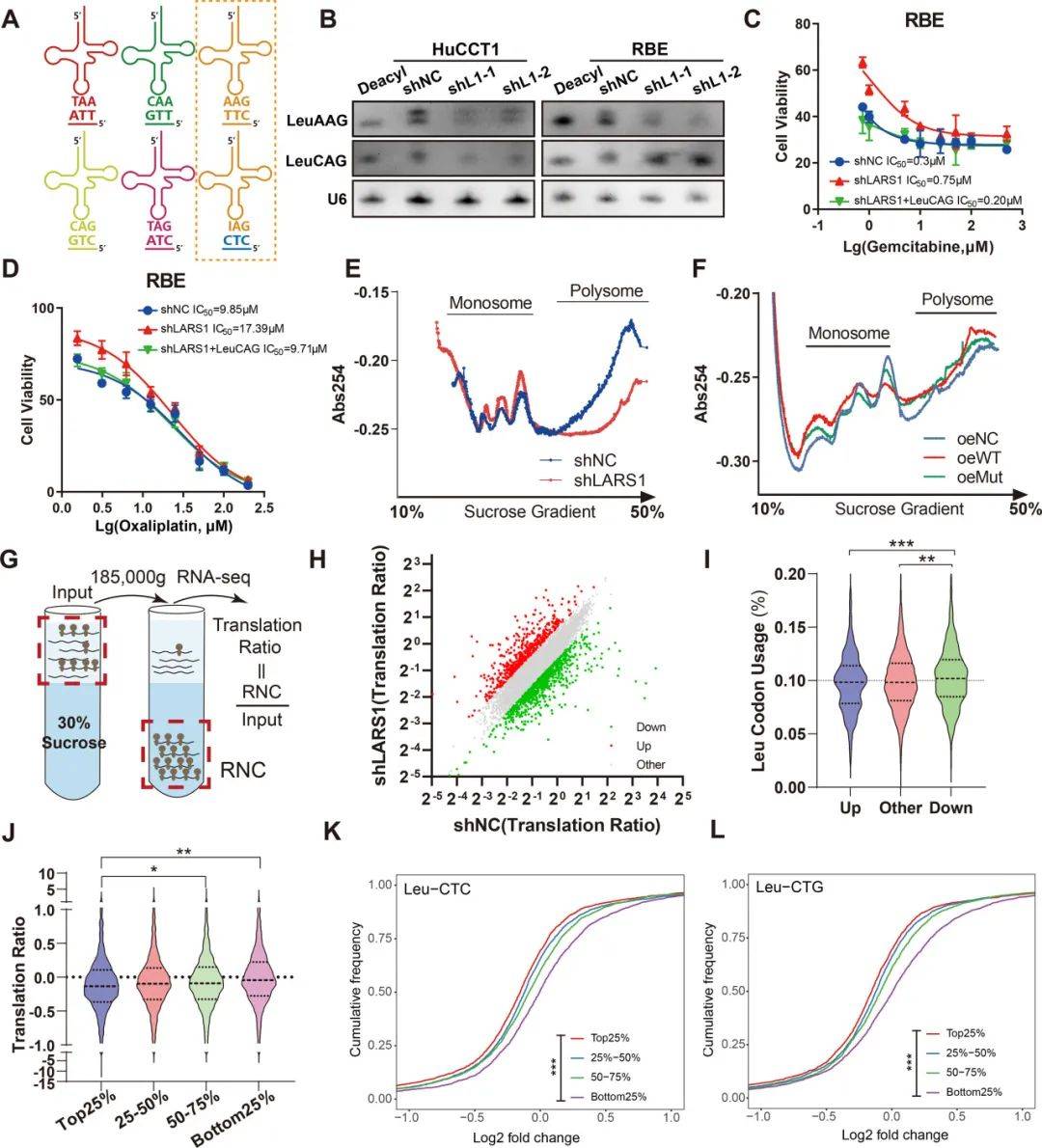 图2 LARS1维持亮酰tRNA库以实现密码子偏向翻译并维持化学敏感性
图2 LARS1维持亮酰tRNA库以实现密码子偏向翻译并维持化学敏感性
LARS1敲低损害ABCC1N-糖基化并增强药物外排以促进化疗耐药性
对照和LARS1敲低ICC细胞中的N-糖基化修饰组分析显示,在典型N-X-S/T(X≠脯氨酸)基序处有109种蛋白质的N-糖基化显著减少,ABCC1成为最佳候选者(图3A)。在Asn-929(N929)处鉴定到一个关键的糖基化位点,在LARS1耗尽后糖基化水平降低(图3B-C)。
从UniProt数据库中注意到N929与两个关键磷酸化位点(Y920和S921)相邻,它们调节ABCC1外排活性。四种ABCC1构建体:野生型(WT)、糖基化缺陷型(N929Q)、磷酸化模拟物(Y920E/S921E)和缺乏糖基化和磷酸化的三重突变体(N929Q/Y920F/S921A)表明N929糖基化丢失诱导的化疗耐药性需要Y920/S921的磷酸化(图3E-F)。这些发现表明,LARS1敲低诱导ABCC1在N929处的糖基化水平降低,从而增强磷酸化依赖性外排活性并促进ICC的化疗耐药性。
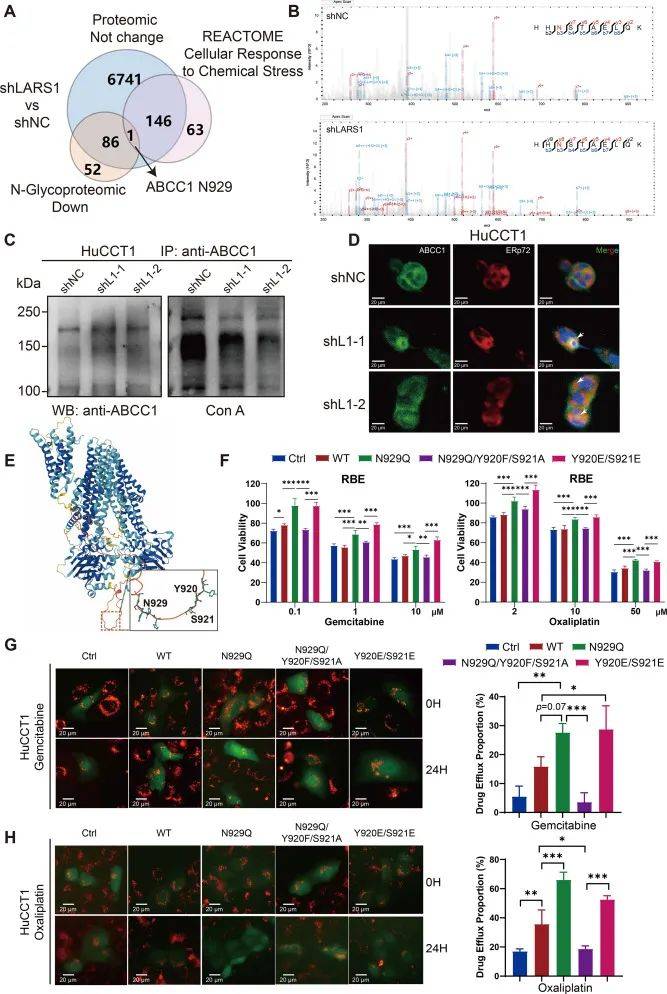 图3 LARS1敲低会损害ABCC1N-糖基化并增强药物外排以促进化疗耐药性
图3 LARS1敲低会损害ABCC1N-糖基化并增强药物外排以促进化疗耐药性
文章小结
本文将肿瘤内源性LARS1确定为翻译重编程中的关键调节因子。从机制上讲,LARS1耗竭破坏了关键N-糖基化酶的翻译,损害了ABCC1糖基化,并增强了化疗耐药性。值得注意的是,补充外源性亮氨酸恢复了LARS1的表达,从而使肿瘤对化疗敏感。这些发现揭示了密码子偏向翻译与化疗耐药之间的机制联系,并支持提高化疗效果的可行饮食策略。
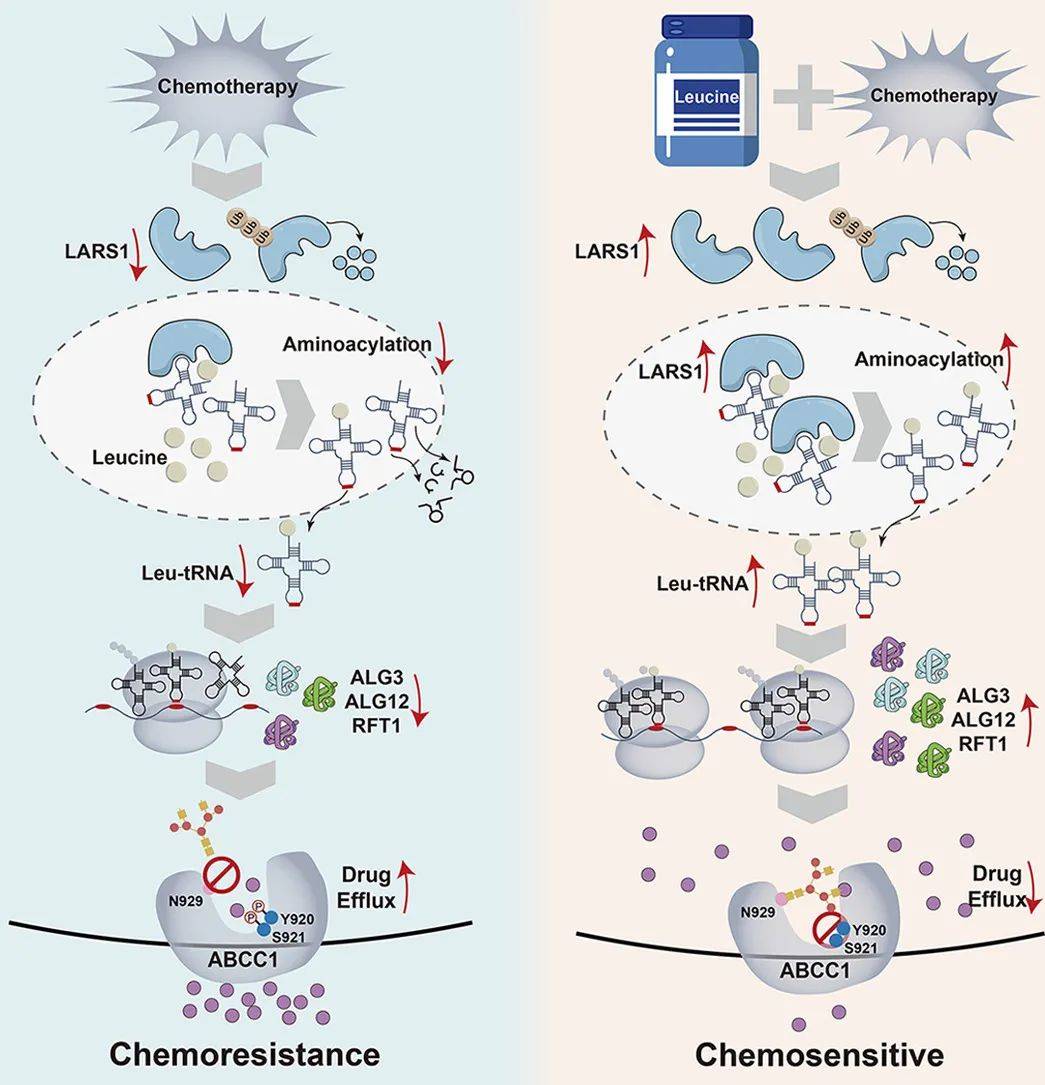 图4 模式图
图4 模式图
拜谱小结
研究揭示了LARS1通过调控N-糖基化逆转ICC化疗耐药的分子机制,为改善ICC化疗疗效提供了全新思路。该研究成果中拜谱生物为其提供蛋白质组学、N-糖基化修饰组的检测服务,拜谱生物作为国内领先的多组学服务公司,可提供蛋白组、修饰组、代谢组、转录组等多组学技术服务。拜谱生物建立了N-糖基化修饰组、完整糖肽蛋白质组、唾液酸化修饰组的全体系糖蛋白组学服务,其中完整糖肽产品可以同时进行N-糖和O-糖的定量分析,实现糖基化位点、糖型、糖肽和糖蛋白的完整解析,助力深入挖掘糖基化在疾病发生与发展中的应用。欢迎咨询!
参考文献:
Liu H, Wang J, Yao Y,et al. Restoration of N-glycosylation via leucine-activated leucyl-tRNA synthetase 1 overcomes chemoresistance in intrahepatic cholangiocarcinoma. J Hepatol. 2025 July. doi: 10.1016/j.jhep.2025.07.008.