

研究表明PKM2具有独立于其典型丙酮酸激酶活性的致癌功能,它是调节基因表达的蛋白激酶。然而,PKM2作为一种组蛋白激酶,其调节三阴性乳腺癌(TNBC)转移的相关基因的转录机制尚不清楚。
近期,南京大学赵权教授团队与江苏省中医院江志伟教授团队合作在Journal of Experimental & Clinical Cancer Research(IF:11.4)上发表了“NONO interacts with nuclear PKM2 and directs histone H3 phosphorylation to promote triple-negative breast cancer metastasis”的研究论文。研究表明依赖于NONO的与核PKM2的相互作用对于三阴性乳腺癌转移的表观遗传调控至关重要,这为治疗三阴性乳腺癌提供了新的干预策略。拜谱生物为该研究提供了蛋白互作组检测分析服务。

英文标题:NONO interacts with nuclear PKM2 and directs histone H3 phosphorylation to promote triple-negative breast cancer metastasis(Journal of Experimental & Clinical Cancer Research IF:11.4)
发表时间:2025.3.10
作者单位:南京大学
组学技术:转录组、蛋白互作组(拜谱生物提供)
研究材料:细胞
研究路线:
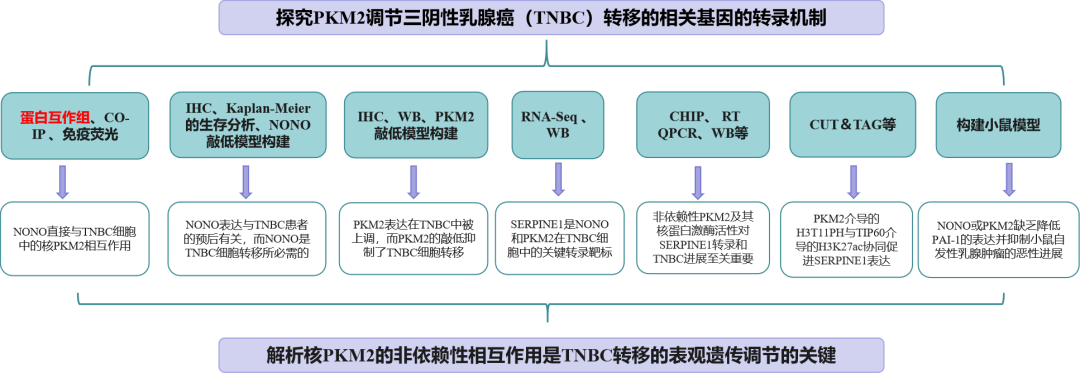
01/研究结果
NONO直接与TNBC细胞中的核PKM2相互作用
尽管其直接的下游转录靶基因尚不清楚,但蛋白质NONO在TNBC中起关键作用,为了鉴定与Nono相互作用的潜在蛋白,其中NONO融合到Bioid2载体的N末端并转导到人MDA-MB-231细胞中。仅包含BIRA生物素连接酶的空载体用作对照。生物素-链霉亲和素亲和力纯化后,使用蛋白互作组分析与NONO相关的蛋白质(TableS1)。利用共免疫沉淀(CO-IP)实验(图1A-C)、GST下拉实验(图1D-F)等实验表明PKM2是一种与TNBC细胞核中NONO相互作用的新型蛋白质。
Table S1.质谱结果(Top 30)
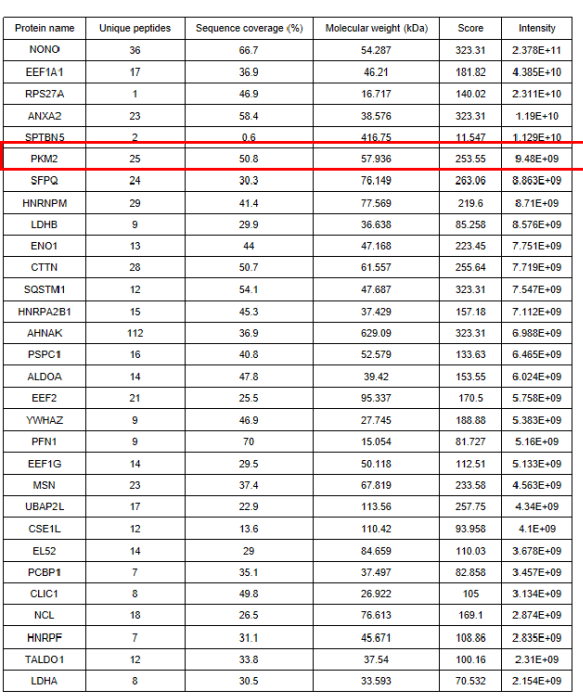
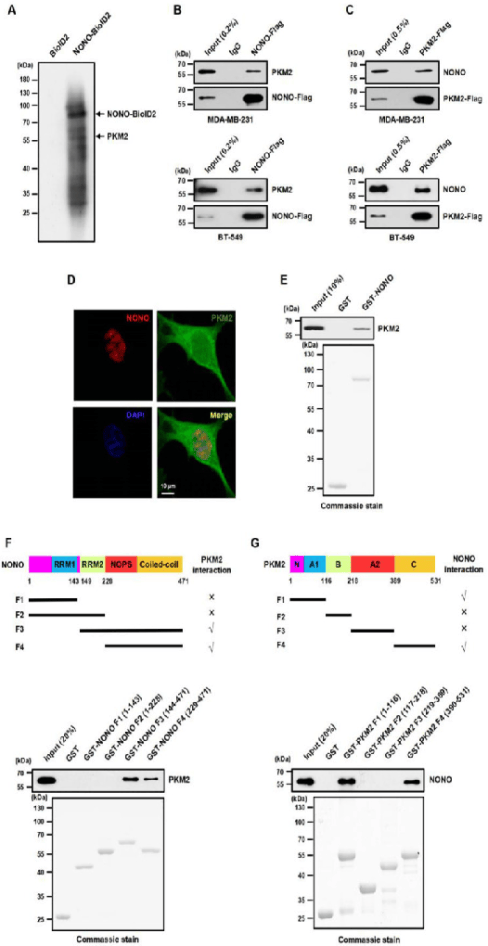 图1:NONO直接与核PKM2相互作用
图1:NONO直接与核PKM2相互作用
PKM2表达与TNBC细胞转移相关
IHC分析表明,与相邻的正常组织相比,人类TNBC组织中的PKM2表达明显更高(图2A-C)。PKM2的表达沉默显著阻碍了细胞增殖,削弱了集落形成能力(图2D-G)。在MMTV-PyMT小鼠乳腺癌模型(FVB背景)中通过AAV将PKM2表达敲低,PKM2的下调显著削弱了肿瘤生长(图2H-K)。因此,通过体外敲低实验和体内动物研究结果表明,PKM2对于TNBC生长和转移至关重要。
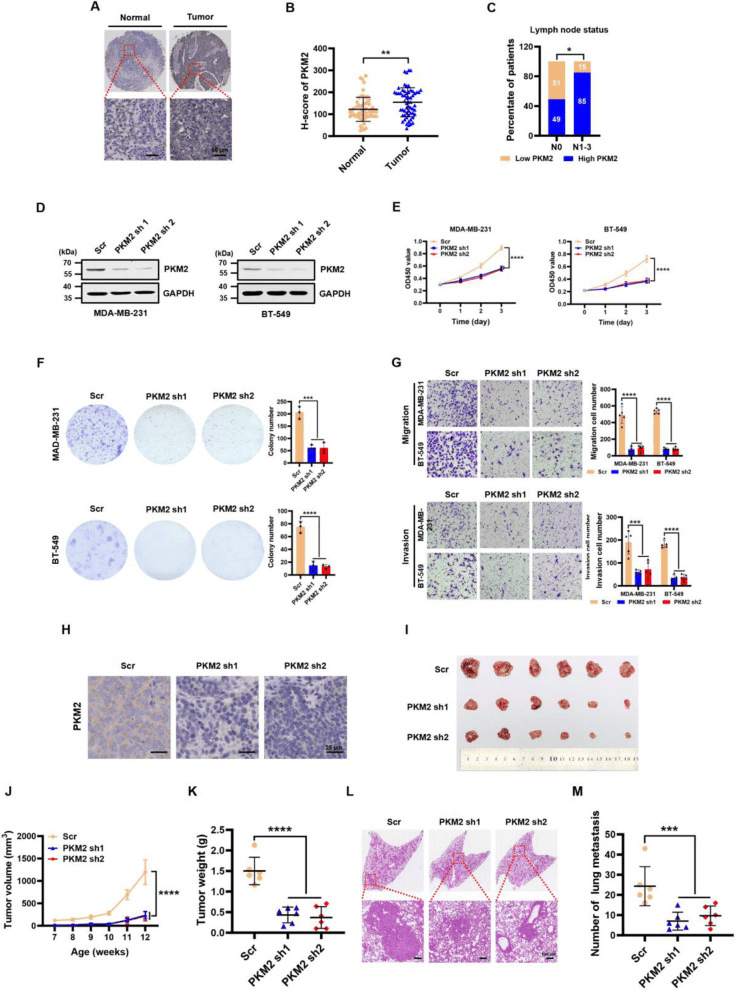 图2:PKM2表达在TNBC中被上调,而PKM2的敲低抑制了TNBC细胞转移
图2:PKM2表达在TNBC中被上调,而PKM2的敲低抑制了TNBC细胞转移
SERPINE1是NONO和PKM2在TNBC细胞中的关键转录靶标
为了确定NONO/PKM2复合物的潜在转录靶标。通过在MDA-MB-231细胞中NONO和PKM2敲低后RNA-Seq结果的综合分析,研究发现NONO敲低后差异表达的基因DEG(451/999)中,近一半也受到PKM2的调节(图3A)。分析表明,这些基因参与调节细胞运动,粘附,迁移和其他生物学过程(图3B),SERPINE1(编码PAI-1蛋白)是NONO或PKM2表达敲低后下调最显著的基因(图3C)。NONO敲低显着降低了SERPINE1在转录和蛋白质水平(图3D-E),PAI-1的过表达在很大程度上挽救了NONO耗竭的细胞中降低的增殖、迁移和侵袭能力(图3F-I)
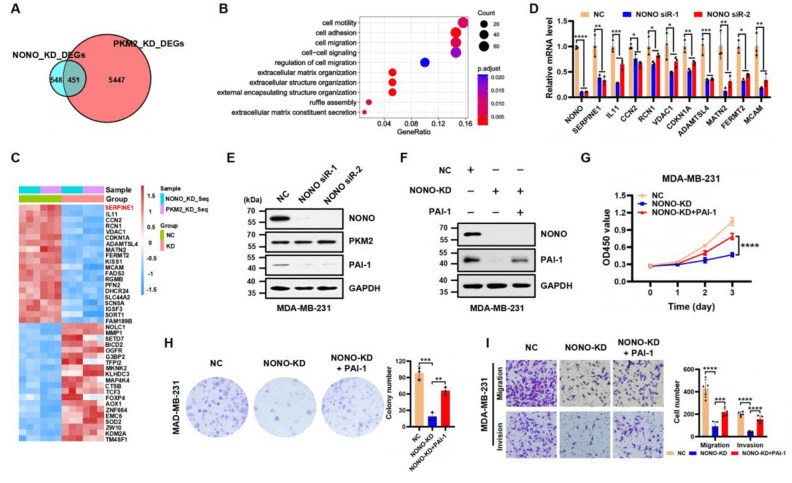 图3:SERPINE1是NONO和PKM2在TNBC中的关键转录靶标
图3:SERPINE1是NONO和PKM2在TNBC中的关键转录靶标
02、文章小结
研究团队利用生物素连接酶的邻近标记技术(BioID2),发现转录因子NONO与细胞核内的丙酮酸激酶PKM2结合并直接相互作用。PKM2不仅是一种细胞代谢催化酶,还能够转位至细胞核中发挥蛋白激酶功能,催化H3T11ph发生。进一步的体内外实验表明,PKM2介导的H3T11ph修饰依赖于NONO,并与PKM2单独调控的乙酰转移酶TIP60介导的组蛋白H3K27ac修饰协同作用,激活丝氨酸蛋白酶抑制剂SERPINE1基因的转录,从而促进TNBC的转移(图4)。
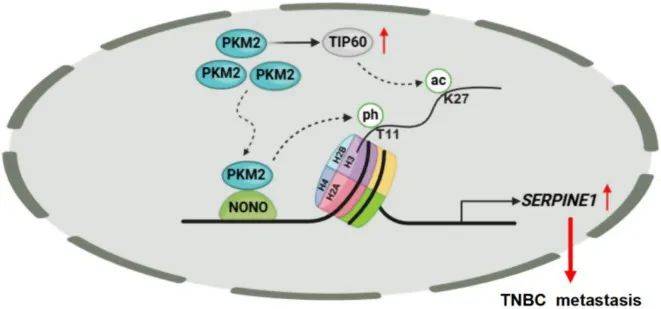 图4:NONO和PKM2相互作用促进TNBC转移模式图
图4:NONO和PKM2相互作用促进TNBC转移模式图
03、拜谱小结
该研究为理解TNBC的恶性进展提供了新的视角,并提出了通过干扰NONO和PKM2蛋白-蛋白相互作用的靶向干预新策略。这一策略有望突破当前肿瘤治疗中PKM2四聚体激动剂与二聚体抑制剂的两难困境,为TNBC患者带来新的希望。拜谱生物为该研究提供了蛋白互作组检测分析服务。拜谱生物建立了完善成熟的转录组学、蛋白组学、代谢组学以及多组学联合产品技术服务体系,助力发表高分文献。欢迎致电咨询!
参考文献:
Li Q, Ci H, Zhao P, et al. NONO interacts with nuclear PKM2 and directs histone H3 phosphorylation to promote triple-negative breast cancer metastasis. J Exp Clin Cancer Res. 2025;44(1):90. Published 2025 Mar 10. doi:10.1186/s13046-025-03343-5