

癌症相关成纤维细胞(CAFs)在癌症中发挥着多种作用,具有作为预后因素和治疗靶点的潜在价值,而CAFs在早期癌症的功能解析及干预策略仍待研究。
中山大学林天歆教授研究团队&陈长昊教授研究团队,在Cancer Cell杂志上发表题为“PDGFRα+ITGA11+ fibroblasts foster early-stage cancer lymphovascular invasion and lymphatic metastasis via ITGA11-SELE interplay”文章。研究通过整合多组学技术,首次鉴定出PDGFRα+ITGA11+CAFs亚群,阐释了癌症相关成纤维细胞在早期膀胱癌淋巴转移中的重要功能,为阻断早期膀胱癌转移提供了全新靶点。拜谱生物为该研究提供了蛋白组学技术服务。

英文标题:PDGFRα+ITGA11+ fibroblasts foster early-stage cancer lymphovascular invasion and lymphatic metastasis via ITGA11-SELE interplay(Cancer Cell IF:48.8)
中文标题:PDGFRa+ITGA11+成纤维细胞通过ITGA11与SELE互作促进早期肿瘤淋巴血管侵袭及淋巴转移
客户单位:中山大学
研究材料:人源肿瘤相关成纤维细胞
拜谱提供技术:蛋白组学
技术路线:
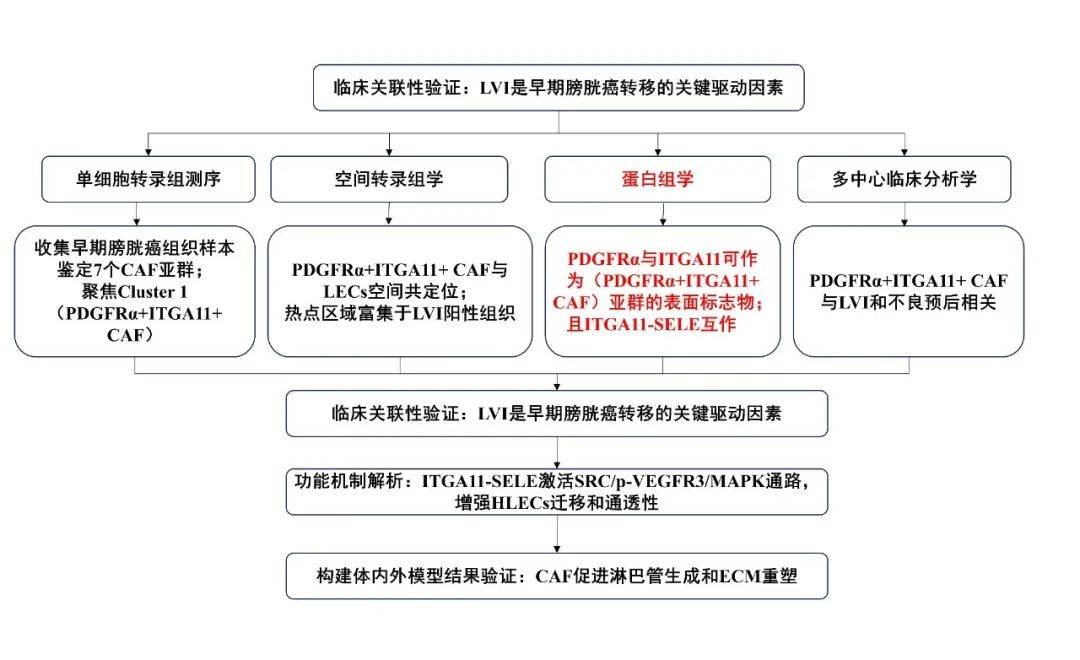
研究结果
01.临床关联性验证
LVI是早期膀胱癌转移的关键驱动因素:研究者整合多中心数据,发现LVI(淋巴血管侵袭)与LN(淋巴结)转移及BCa(早期膀胱癌)预后紧密相关。早期(T1期)膀胱癌若伴LVI,其淋巴结转移率显著高于无LVI的晚期肿瘤(图1A-C),且患者预后更差。这一反常现象提示,LVI不仅是转移标志,更是早期肿瘤恶性进展的独立驱动因素。
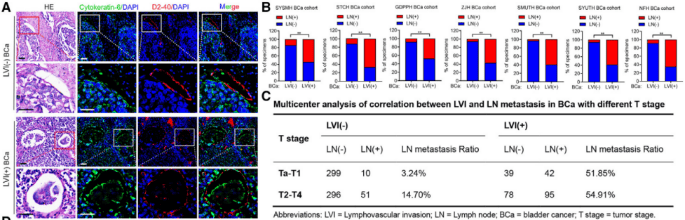 图1 具有LVI的早期BCa的单细胞转录组学分析
图1 具有LVI的早期BCa的单细胞转录组学分析
02.单细胞图谱揭示关键CAFs亚群
通过scRNA-seq分析LVI阳性与阴性早期膀胱癌组织,研究者发现LVI阳性样本中成纤维细胞显著富集(图2D-H)。进一步分群鉴定出7个CAFs亚群,其中PDGFRα+ITGA11+ CAFs细胞亚群在LVI阳性组织中特异性升高,且与患者不良预后正相关(图2N-P)。蛋白组学与流式细胞术验证表明,PDGFRα与ITGA11可作为该亚群的表面标志物。
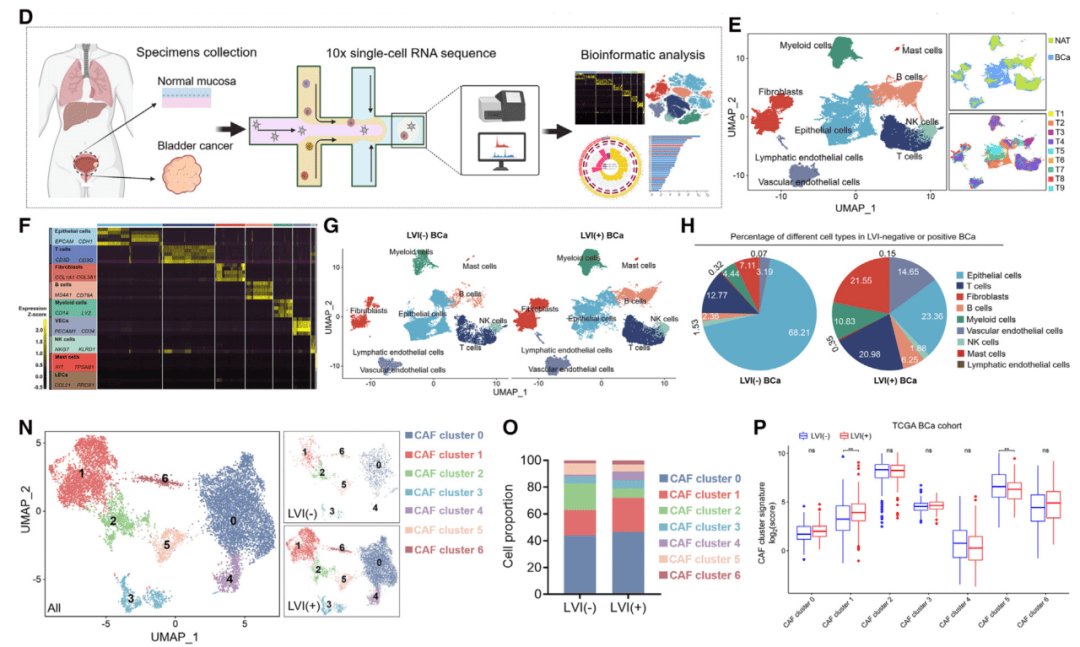 图2 PDGFRα+ITGA11+ CAFs与早期BCa的LVI和LN转移有关
图2 PDGFRα+ITGA11+ CAFs与早期BCa的LVI和LN转移有关
03.功能验证
PDGFRα+ITGA11+ CAFs驱动淋巴转移:研究者通过构建PDGFRα+ ITGA11+ CAFs条件性敲除小鼠模型,以明确该亚群细胞功能。在致癌剂BBN诱导的早期膀胱癌中,敲除组淋巴结转移率显著降低(图3C-E),且微淋巴管密度(MLD)和淋巴血管侵袭(LVI)减少(图3F-G)。经原位膀胱癌模型进一步证实,PDGFRα+ITGA11+ CAFs可促进淋巴管生成并增强癌细胞侵袭。
 图3 小鼠敲除PDGFRα+ITGA11+ CAFs抑制早期BCa的LVI和LN转移
图3 小鼠敲除PDGFRα+ITGA11+ CAFs抑制早期BCa的LVI和LN转移
04.分子机制
ITGA11-SELE轴激活淋巴管信号通路:空间转录组与共聚焦成像结果显示,PDGFRα+ITGA11+CAFs紧密环绕淋巴管内皮细胞(LECs)(图4A-E)。通过蛋白互作组学探究分子机制,结果揭示CAFs通过表面ITGA11与LECs的SELE蛋白结合(图4H-J),激活SRC-p-VEGFR3-MAPK通路,促进淋巴管生成并破坏内皮连接。抑制该通路可逆转CAFs的促转移效应。
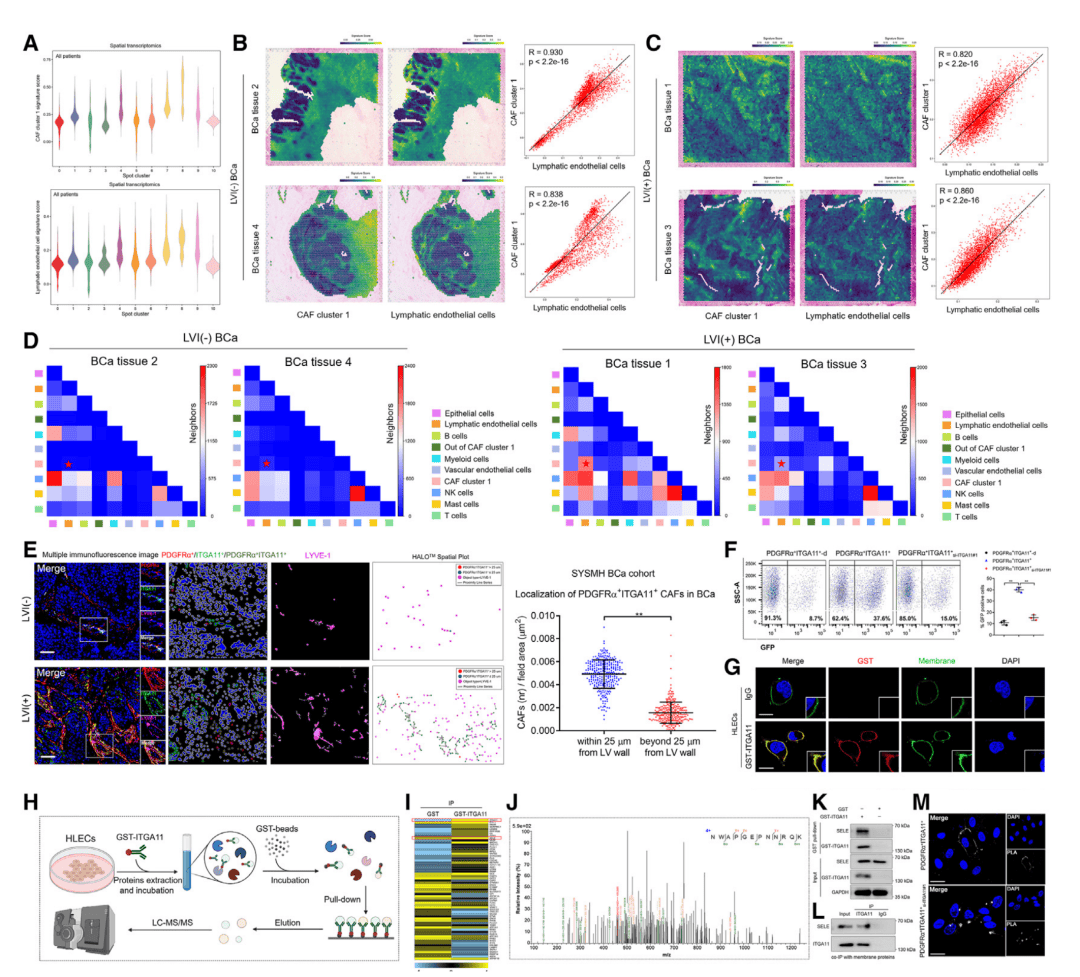 图4 PDGFRα+ITGA11+ CAFs促进淋巴管生成机制
图4 PDGFRα+ITGA11+ CAFs促进淋巴管生成机制
05.ECM重塑
基于CHI3L1-MMP2轴为BCa细胞提供侵入淋巴管的路径:除调控淋巴管外,PDGFRα+ITGA11+CAFs通过分泌CHI3L1激活MMP2,驱动胶原纤维线性排列(图5E-I),形成利于癌细胞迁移的ECM结构(图5J)。临床样本中,CHI3L1与MMP2表达与CAFs浸润及LVI程度正相关,而使用针对CHI3L1的中和抗体(αCHI3L1)治疗可以有效抑制PDGFRα+ITGA11+CAFs促进ECM重塑及转移的能力。
 图5 PDGFRα+ITGA11+ CAFs通过重塑ECM协助BCa细胞渗入淋巴管
图5 PDGFRα+ITGA11+ CAFs通过重塑ECM协助BCa细胞渗入淋巴管
06.临床转化潜力
联合靶向策略抑制早期转移:基于上述机制,研究者开发了ITGA11与CHI3L1双靶点中和抗体。在患者来源异种移植(PDX)模型中,联合治疗显著降低淋巴管密度、恢复内皮连接,并抑制LVI形成(图6D-E),为临床转化提供了直接依据。
 图6 靶向PDGFRα+ITGA11+ CAFs的联合治疗抑制早期BCa的LVI
图6 靶向PDGFRα+ITGA11+ CAFs的联合治疗抑制早期BCa的LVI
文章小结
本研究系统解析了PDGFRα+ITGA11+CAFs在早期膀胱癌转移中的关键作用:一方面通过ITGA11-SELE互作激活淋巴管内皮信号,另一方面通过CHI3L1-MMP2轴重塑ECM架构,双管齐下驱动癌细胞侵袭(图7)。这一发现不仅推动了早期肿瘤微环境的研究,更提出了靶向CAFs亚群的全新治疗策略,为改善膀胱癌患者预后提供了理论基石与转化方向。
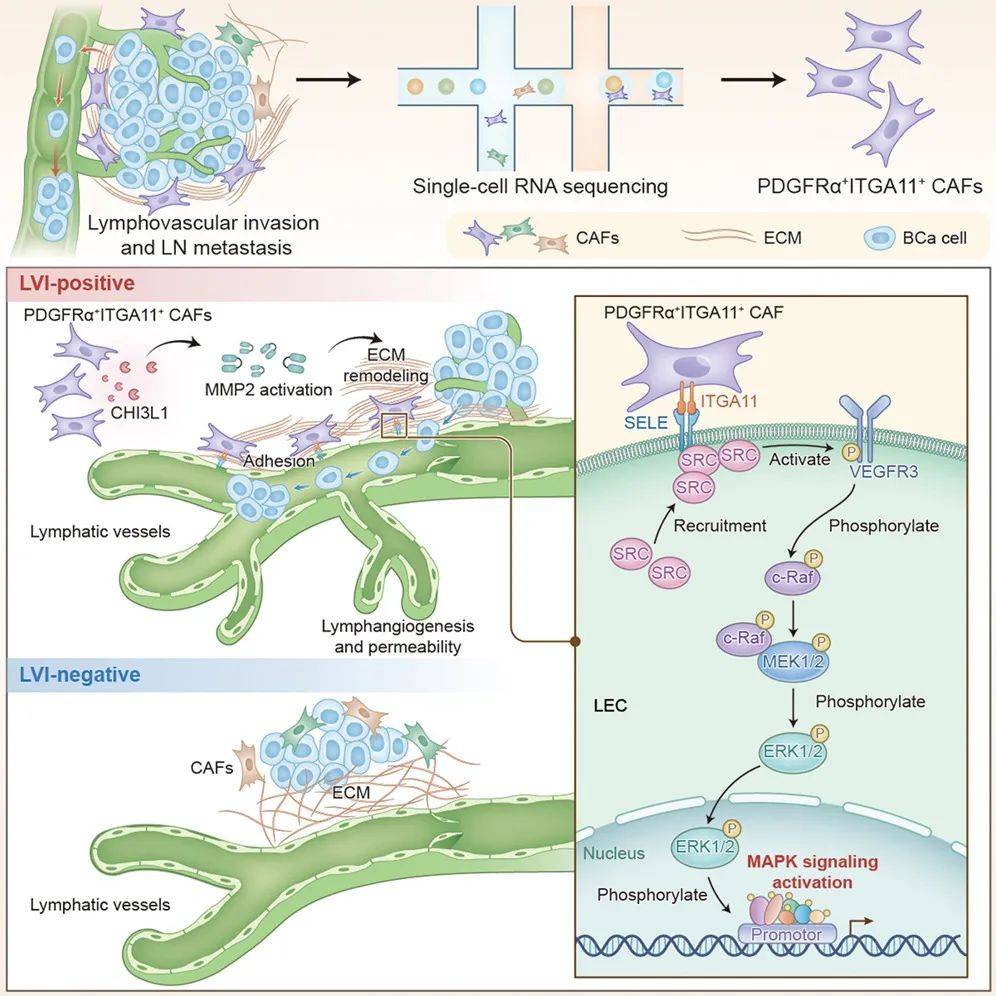 图7 PDGFRα+ITGA11+ CAFs驱动早期膀胱癌淋巴转移的新机制
图7 PDGFRα+ITGA11+ CAFs驱动早期膀胱癌淋巴转移的新机制
拜谱小结
本研究通过多组学技术,深入研究特定CAFs亚群在早期BCa转移性微环境中的作用,提供了全新的治疗靶点,拜谱生物提供了蛋白组学检测与分析服务。拜谱生物在生物技术和质谱检测领域不断深耕发展并具备关键的核心竞争力,可提供修饰蛋白组学&蛋白组学、代谢组学、单细胞转录组&空间多组学等组学检测服务,致力于推动疾病研究进展,为精准医学提供前沿研究工具和检测手段。欢迎咨询!
参考文献
Zheng H, An M, Luo Y, Diao X, Zhong W, Pang M, Lin Y, Chen J, Li Y, Kong Y, Zhao Y, Yin Y, Ai L, Huang J, Chen C, Lin T. PDGFRα+ITGA11+ fibroblasts foster early-stage cancer lymphovascular invasion and lymphatic metastasis via ITGA11-SELE interplay. Cancer Cell. 2024 Apr 8;42(4):682-700.e12. doi: 10.1016/j.ccell.2024.02.002.