利用定量蛋白质组学分析揭示青稞积累花青素的相关蛋白质和途径
Quantitative proteomics analysis reveals proteins and pathways associated with anthocyanin accumulation in barley
应用组学:TMT+PRM
期刊:Food Chemistry(IF=5.399)

青稞(Hordeum vulgare L.)是禾本科植物中最古老的谷类植物之一,目前在世界产量中排名第四,仅次于玉米(Zea mays)、小麦和水稻。谷物中的花青素有许多健康益处,包括抗炎、抗氧化、保护肝脏、保护视网膜、保护神经、降血脂、抗血糖、调节体重、抗癌和抗衰老。
本研究采用串联质谱TMT-LC-MS/MS方法测定了紫色、蓝色和白色青稞花青素生物合成过程中蛋白表达水平及其相关功能。此外,作者使用了靶向定量蛋白质组学PRM来验证重要蛋白质。蛋白质组学实验及PRM检测分析工作是由拜谱生物完成的。
技术路线图
实验结果
总花青素含量在紫色、蓝色和白色青稞籽粒(H、M和L)中差异显著(图1)。在三种有色籽粒中,H组中花青素含量最高,其总花青素含量为46.62±3.51 mg/100g,在蓝色青稞中为8.24±1.78mg/ 100g,而在白色籽粒中未检出花青素。
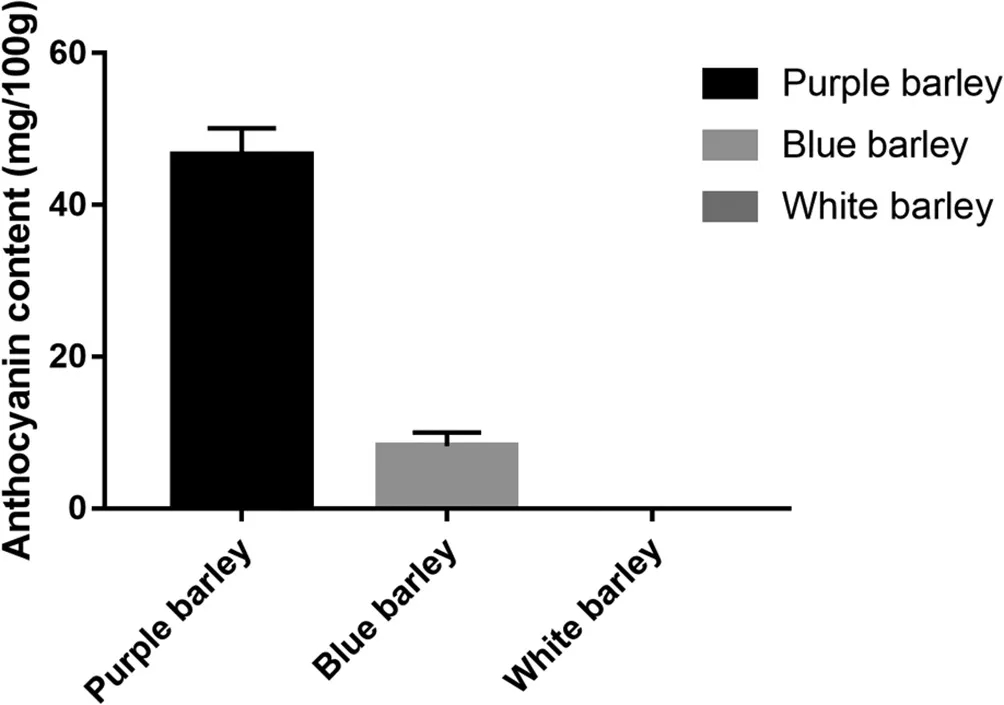
Fig. 1. 花青素总含量
2.TMT定量蛋白质组学分析
蛋白质组学分析到的肽谱匹配数、肽段总数、唯一性肽段数量、蛋白总数和可定量蛋白数分别为56468、16909、14602、3564、3461。作者利用9个样本(3组,每组别3个重复)的皮尔逊相关系数来评估蛋白质组学实验的重复性好坏,结果显示重复性比较高(R > 0.99) (Fig.2B)。

Fig. 2. 差异表达蛋白的火山图
3.差异蛋白质分析
H vs L中,鉴定出297个差异蛋白质(DEPs),其中155个上调,142个下调。H vs M中,鉴定出300个DEPs,其中162个上调,138个下调。此外,在L vs M中鉴定出254个DEPs,155个上调和99个下调。此外,作者使用方差分析在H vs L vs M组中确定了1421个DEPs (Fig.2C, D, E)。
4. DEPs的功能富集分析
通过生物信息学分析预测不同比较组DEPs的功能。结果表明,在H vs L、H vs M, L vs M,H vs M vs L组中,对于生物过程BP,DEPs主要富集在小分子的代谢过程,有机氮化合物生物合成和代谢过程,单一生物体代谢过程。对于细胞组分CC,主要富集在细胞质、细胞内和细胞组分。对于分子功能MF,DEPs与氧化还原酶活性、核糖体结构成分、结构分子活性和辅因子结合有关。在H vs L,H vs M, L vs M,H vs M vs L中,KEGG分析表明,DEPs主要是参与碳代谢,氧化磷酸化,核糖体,内质网蛋白加工,代谢途径和氨基酸及次生代谢物的生物合成。
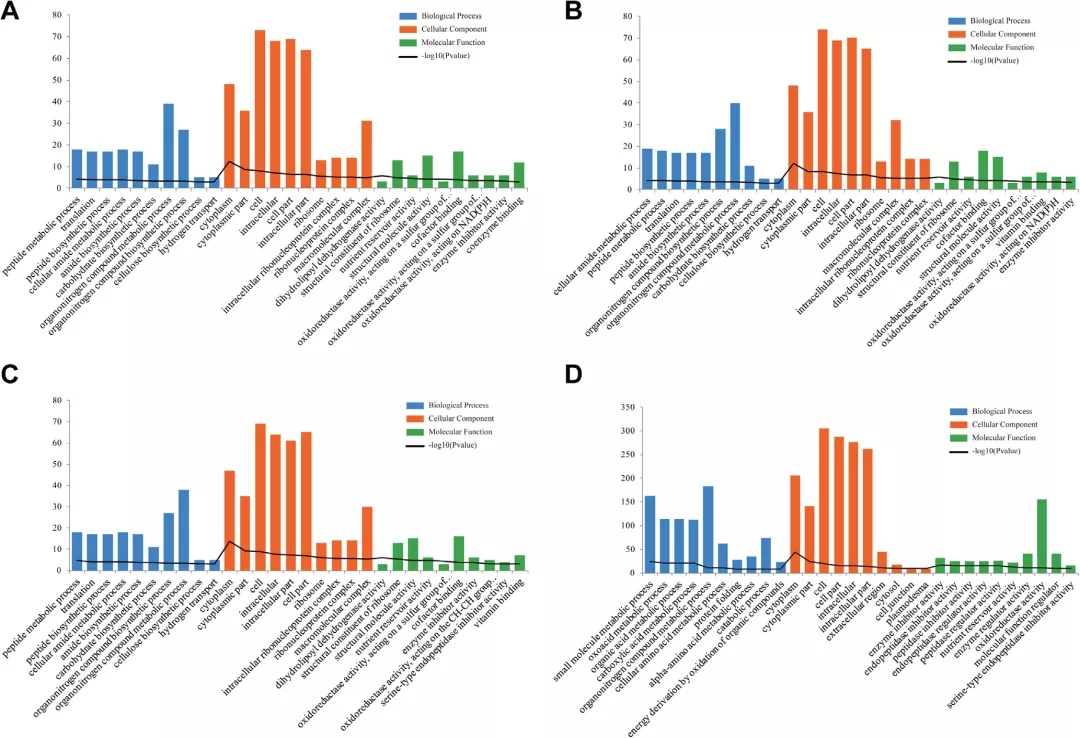
Fig. 3. H vs. L (A), H vs. M (B), L vs. M (C)和 H vs. M vs. L (D) 差异蛋白质的GO富集分析
5.DEPs的PPI网络构建
为了进一步研究这些蛋白的功能,构建了差异蛋白的PPI网络。如Fig.4A所示,在H vs L中,DEPs的PPI网络中,蛋白质,例如MUBI(下调;泛素-40 -核糖体蛋白),A0A287IFH6(上调;未命名蛋白)和F2CY09(上调;预测蛋白)具有高度的相关性,这表明与其他蛋白的相互作用更多。在H vs M组(Fig.4B), F2D355(上调;预测蛋白),A0A1C9ZNX9(上调;ATP合成酶)和F2CY09(上调;预测蛋白)具有较高的相关性。F2D355(上调;预测蛋白),A0A287IFH6(上调;未命名蛋白)和A0A287EYB0(下调;未命名蛋白)在L vs M组的PPI网络中具有高度的相关性(Fig.4C)。此外,作者还对H vs M vs L组鉴定的DEPs进行PPI分析(Fig.4D)。在这四个PPI网络中, A0A287F6S1(无特征的蛋白质),A0A287E139(琥珀酸脱氢酶(辅酶q)黄素蛋白亚基,线粒体),M0VD47(无特征的蛋白质),A0A287F1X0(无特征的蛋白质),M0XDX5(无特征的蛋白质)和F5B7F0 (乙酰乳酸合成酶(片段))均被发现,而且有相对高度的相关性。
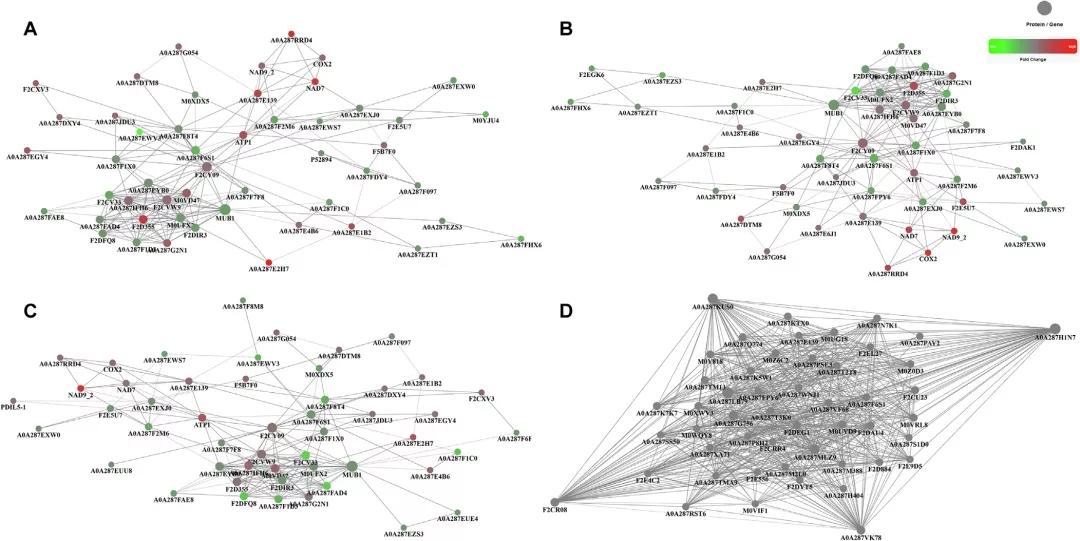
Fig. 4. H vs. L (A), H vs. M (B), L vs. M (C)和 H vs. M vs. L (D)差异蛋白质的PPI相互作用网络分析
6 H vs M vs L蛋白聚类分析
根据H vs M vs L组中蛋白表达模式不同(Fig.5A)将蛋白分为6类(Fig.5B)。在Cluster 1中,H vs L组的蛋白表达下调。Cluster 2中,M vs H组中蛋白表达下调;而在L vs M组中上升。在Cluster 3中,M vs H组中蛋白表达轻度上调,L vs M组蛋白表达轻度下调,而在Cluster 4中,M vs H组中蛋白表达轻度上调,L vs M组中蛋白表达轻度下调。在Cluster 5中,H vs M组中蛋白表达略有下调;而在L vs M组中表达上调。最后在Cluster 6中, H vs L组的蛋白表达是上调的。
为了进一步理解蛋白的机制机理和生物功能,作者还进行了GO和KEGG分析。在6个类别中,小分子的代谢过程,防御反应,碳水化合物衍生物代谢过程和细胞分解过程是BP中最重要的部分;胞质部分、细胞部分和胞内部分是CC类中最重要的部分;而辅因子结合、催化活性和酶调节活性是MF类中最重要的部分。KEGG富集分析显示其主要途径为碳代谢、氨基酸生物合成、代谢途径和次生代谢产物生物合成。
进一步,作者对这6个类别的蛋白构建了PPI网络(Fig.6)。结果表明,Cluster 1中的蛋白质 (Fig.6A) 主要是与氨基酸生物合成,碳代谢,丙酮酸代谢,代谢途径和次生代谢产物的生物合成相关,包括F2ELT5(苹果酸脱氢酶),F2CV88 (40 s核糖体蛋白S26), A0A287GW56(α亚基丙酮酸脱氢酶E1组件),F5B7F0 (乙酰乳酸合成酶),P52894(丙氨酸转氨酶2)和A0A287WNJ1(苹果酸酶)。Cluster 2蛋白 (Fig.6B) 主要与氨基酸和次生代谢产物的生物合成,乙醛酸和二羧酸根阴离子代谢,如A0A287N3J4(谷氨酰胺合成酶),A0A287SQZ2 (亚甲基四氢叶酸还原酶),F2DKD7(α亚基丙酮酸脱氢酶E1组件),Q94IC0(甜菜碱醛脱氢酶),M0UG18(柠檬酸合成酶)A0A287G756 (δ-1-吡咯啉-5-羧酸盐合成酶)和A0A287Q774(苹果酸酶)。Cluster 3中的蛋白 (Fig.6C) 包括A0A287TTB0(磷酸甘油酸激酶)和M0Z0D3(苹果酸脱氢酶),与戊糖磷酸途径、内吞作用、代谢途径、光合生物固碳、碳元共生、氨基酸和次级代谢物的生物合成有关。Cluster 4中的蛋白质 (Fig.6D) 参与氨基糖和核苷酸糖代谢,糖酵解/糖质新生,光合生物固碳作用,蛋白质的内质网加工、蛋白运输和丙酮酸代谢,如A0A287US34(α亚基丙酮酸脱氢酶E1组件),Q1PBI4 (葡萄糖-6-磷酸异构酶)和F2DCT3 (焦磷酸盐-果糖6-磷酸基1-磷酸转移酶亚基α)。Cluster 5中的蛋白 (Fig.6E),包括Q9ZRI8(甲酸脱氢酶、线粒体)、M0VN24(异柠檬酸裂解酶)、A0A287F2M6 (ATP合酶亚单位γ)、A0A287S239(蛋白酶体亚单位α型)、A0A287KTX0(丙酮酸激酶),参与了氨基糖和核苷酸糖代谢、代谢途径、碳代谢、氧化磷酸化和蛋白酶体。Cluster 6中的蛋白质 (Fig.6F),包括F2DBE3(过氧化氢酶),F2DAK8(预测蛋白质),F2CPZ4 (酰基碳烯氧化酶),F2CU23 (甘油醛-3-磷酸脱氢酶),和F2CXV3(核苷二磷酸激酶),与次生代谢产物的生物合成,蛋白质内质网加工,代谢途径,碳代谢,苯丙素生物合成相关。

Fig. 5. H vs. M vs. L 的聚类分析
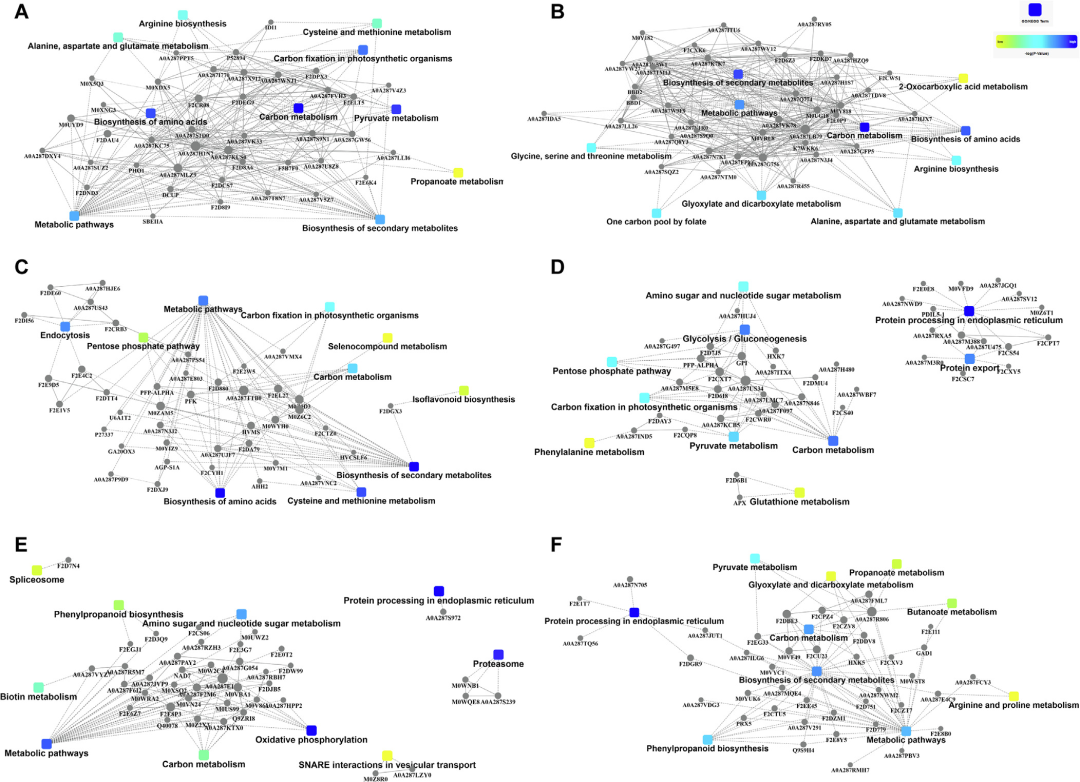
Fig. 6. 六大类别的PPI互作网络分析
7 PRM验证
作者选择了6种蛋白进行PRM验证,证实TMT蛋白组学结果的可靠性。如Fig.7所示,PRM结果与TMT数据具有良好的相关性。A0A287E139(琥珀酸脱氢酶(辅酶Q)黄蛋白亚基,线粒体)、A0A287G756(δ-1-吡咯啉-5-羧酸合成酶)、M0UG18(柠檬酸合成酶)在各组中表达最低。另外,H vs L中,Cluster 6中的F2CXV3(核苷二磷酸激酶)和F2CU23(甘油醛-3-磷酸脱氢酶)水平升高。M组中M0Z0D3(苹果酸脱氢酶)表达水平高于H组和L组。

Fig. 7. 青稞花青素合成相关蛋白的PRM验证
总结
这篇文章结构清晰,信息量充足,作者采用了蛋白组学并进行了PRM靶向蛋白验证,从蛋白组学层面上分析了青稞籽粒颜色不同的原因。小编认为,作者找到了一些与花青素合成相关的一些蛋白,但是没有未对蛋白下游产物进行进一步分析。小编建议后续试验中可以使用代谢组学的方法检测不同颜色籽粒中代谢物的变化,进一步从代谢水平解释蛋白表达变化带来的影响。此篇文章可以为研究植物表征,分子遗传、表观遗传等相关领域的老师和同学们提供一定的参考,使更多的老师能够借助组学相关的技术解决更多的科学问题。